Лабораторный и промышленный способы получения хлората калия. Получение хлорной извести
Задача 827.
Рассчитать, какое количество бертолетовой соли можно получить из 168 г гидроксида калия.
Решение:
М(КОН) = 56 г/моль, m(KOH) = 6 . 56 = 336 г;
М(KClO3) = 122,45 г/моль, m(KClO3) = 122,45 г.
Уравнение реакции имеет вид:
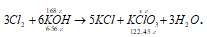
Находим массу бертолетовой соли из пропорции:
168 : 336 = х : 122,45;
х = (168 . 122,45)/336 = 61,225 г.
Количество бертолетовой соли рассчитаем из уравнения:
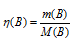 , где
, где
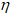 (B) - количество вещества, моль;
(B) - количество вещества, моль;
m(B) - масса вещества, г;
M(B) - молярная масса вещества (В), г/моль.
Тогда
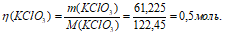
Ответ: m(KClO3) = 61,225 г; М(KClO3) = 0,5 моль.
Задача 828.
Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Написать уравнения процессов, которые необходимо для этого осуществить. Какие при этом получаются побочные продукты?
Решение:
Получение хлорной извести, исходя из карбоната кальция, хлорида натрия и воды.
а) При нагревании в 1000 0С карбонат кальция разлагается на оксид кальция и углекислый газ:
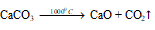
б) Оксид кальция, растворяясь в воде, образует гидроксид кальция:
СаО + Н2О → Са(ОН)2.
в) Электролизом водного раствора хлорида натрия можно получить хлор, который выделяется у анода:
Электродные процессы:
у катода: 2Н2О + 2 = Н2↑ + 2ОН-;
= Н2↑ + 2ОН-;
у анода: 2Cl- +2 = Cl2↑.
= Cl2↑.
г) При действии хлора на гашеную известь получается так называемая белильная (или хлорная) известь и вода:
Ca(OH)2 + Cl2 → CaOCl2 + H2O.
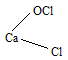
CaOCl2 соответствует структурная формула:
Хлорная известь применяется для отбелки растительных волокон (тканей, бумаги) и для дезинфекции.
Задача 829.
Обосновать невозможность получения оксидов хлора непосредственным взаимодействием хлора с кислородом.
Решение:
Хлор непосредственно не взаимодействует с кислородом. Это обусловлено небольшой энергией связи Cl—O и невозможностью использования высоких температур для осуществления реакций:
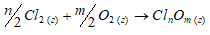
Для них  S < 0.
S < 0.
Так
 H0(Cl2O) = 75,7 кДж/моль;
H0(Cl2O) = 75,7 кДж/моль;
 H0(ClO2) = 105,0 кДж/моль;
H0(ClO2) = 105,0 кДж/моль;
 H0(Cl2O7) = 251,0 кДж/моль.
H0(Cl2O7) = 251,0 кДж/моль.
Рассмотрим реакцию:
2Cl2(г) + О2(г) → 2Cl2O;  H = 151,4 кДж/моль.
H = 151,4 кДж/моль.
Из данного уравнения реакции видно, что процесс идёт с поглощением теплоты. Так как  G, то равновесие системы смещается влево, т.е в сторону разложения Cl2O. К тому же реакция протекает с уменьшением числа молей газообразных веществ, т.е. система упорядочивается и, следовательно,
G, то равновесие системы смещается влево, т.е в сторону разложения Cl2O. К тому же реакция протекает с уменьшением числа молей газообразных веществ, т.е. система упорядочивается и, следовательно,  S < 0.
S < 0.
Исходя из уравнения:
 G =
G =  H - T
H - T S.
S.
При положительном значении дельта  H и отрицательном значении
H и отрицательном значении  S, если даже повышать температуру, то член равенства (T
S, если даже повышать температуру, то член равенства (T S) всё равно будет иметь положительное значение [-T .
S) всё равно будет иметь положительное значение [-T .  S = T
S = T S], что указывает на то, что
S], что указывает на то, что  G всегда будет иметь положительное значение, а при
G всегда будет иметь положительное значение, а при  G > 0 процесс не протекает самопроизвольно.
G > 0 процесс не протекает самопроизвольно.
Задача 830.
Указать лабораторный и промышленный способы получения хлората калия.
Решение:
а) В лаборатории хлорат калия получают электролизом горячего раствора КCl:
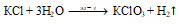
При охлаждении раствора хлорат калия выпадает в осадок, так как мало растворим в холодной воде.
б) В промышленности хлорат калия получают пропусканием хлора в горячий раствор гидроксида калия:
3Cl2 + 6KOH  5KCl + KClO3 + 3H2O.
5KCl + KClO3 + 3H2O.
Поскольку хлорат калия (или бертолетовая соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.

