"Химия. 8 класс". О.С. Габриелян (гдз)
Биография А. Авогадро - великого итальянского химика
Ответ на вопрос 1 (1).
Закон Авогадро: в равных объемах различных газов при одинаковых условиях (температуре, давлении) содержится одинаковое число молекул.
Это дало возможность легко и точно определить относительные массы молекул газообразных веществ.
Ответ на вопрос 2 (2).
Газы при нагревании расширяются, т.е. занимают больший объем, таким образом, в разных условиях разное количество газов может занимать одинаковый объем. С повышением давления газы сжимаются, что также отражается на объеме.
Ответ на вопрос 3 (3).
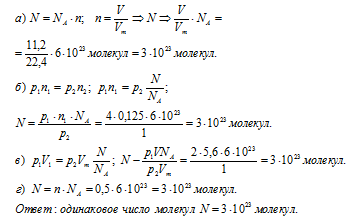
Ответ на вопрос 4 (4).
NH3 — аммиак; Н2S — сероводород; С2H4 — этилен; СН4 — метан;
Н2O — вода; СО2 — углекислый газ; СО — угарный газ;
N2O — оксид азота (I) NO — оксид азота (II); N2O3 — оксид азота (III);
NO2 — оксид азота (IV); N2O5 — оксид азота (V); N2 — азот;
O2 — кислород; Н2 — водород.
Авогадро смог правильно рассчитать массы и формулы этих соединений делением их плотностей на плотность водорода, принятую за эталон.
Ответ на вопрос 5 (5).
N2 — азот; O2 — кислород; Н2 — водород.
Авогадро стал первым, кто записал эти формулы именно в таком виде.
Ответ на вопрос 6 (6).
Большую часть воздуха составляют азот и кислород, имеющие относительные молекулярные массы 28 и 32 соответственно. Пары воды имеют относительную молекулярную массу 18, что меньше азота и кислорода. Поэтому 1 л влажного воздуха, в котором молекулы азота и кислорода замещаются на молекулы воды, будет легче.

