Решение задач по химии на расчет нормальности раствора щелочи и кислоты
Задача 443.
На нейтрализацию 40 мл раствора щелочи израсходовано 25 мл 0,5н. раствора H2SO4. Какова нормальность раствора щелочи? Какой объем 0,5 Н. раствора НСI потребовался бы для той же цели?
Решение:
Для вычисления по результатам титрования используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) . V(A) = CЭ(B) . V(B),
где
CЭ(А) и CЭ(B) - нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) - объёмы растворов веществ А и В.
Тогда

Ответ: 0,3H; 24 мл.
Задача 444.
Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось 25 мл 2н. раствора щелочи. Определить эквивалентную массу кислоты.
Решение:
Для расчета используем формулу:
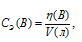 где
где
СЭ(В) – молярная концентрация эквивалента вещества В; V(мл) – объём раствора; n(B) – количество эквивалентов вещества В.
Тогда
n(щелочи) = СЭ(щелочи) . V(щелочи) = 2 . 0,025 = 0,05Н
Кислота и щёлочь реагируют в эквивалентных отношениях, поэтому количество щёлочи равно количеству кислоты. Зная количество кислоты и её массу можно вычислить молярную массу эквивалентов её по формуле:
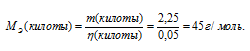
Ответ: 45 г/моль.
Задача 445.
На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25н. раствора кислоты. Рассчитать эквивалентную массу щелочи.
Решение:
Для расчета используем формулу:
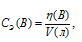 где
где
СЭ(В) – молярная концентрация эквивалента вещества В; V(мл) – объём раствора; n(B) – количество эквивалентов вещества В.
Тогда
n(кислоты) = СЭ(кислоты) . V(кислоты) = 0,25 . 24 = 0,006Н
Теперь рассчитаем массу щёлочи из пропорции:
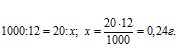
Кислота и щёлочь реагируют в эквивалентных отношениях, поэтому количество щёлочи равно количеству кислоты. Зная количество щёлочи и её массу можно вычислить молярную массу эквивалентов её по формуле:
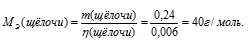
Ответ: 40г/моль.
Задача 446.
Какой объем 15%-ного (по массе) раствора H2SO4 (p = 1,10 г/мл) потребуется для полного растворения 24,3 г Мg, 27 г Al?
Решение:
а) Находим массу 1000 мл раствора по формуле:
m(p-pa) = p . V,
где
p - плотность, а V – объём раствора, получим:
m(p-pa) = 1,10 . 1000 = 1100г.
Массу серной кислоты рассчитаем из пропорции:
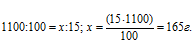
Уравнение реакции имеет вид:
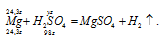
Рассчитаем объём раствора серной кислоты необходимый для растворения 24,3г магния из пропорции
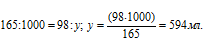
б) Уравнение реакции имеет вид:
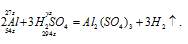
Рассчитаем массу серной кислоты, которая прореагировала с 27г алюминия из пропорции:
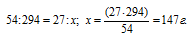
Рассчитаем объём раствора серной кислоты необходимый для растворения 27г алюминия из пропорции:
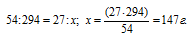
Ответ: 594 мл; 891 мл.

