Задачи по химии на расчеты ионных и изотонических коэффициентов электролитов
Задача 514.
Рассчитать концентрацию ионов CH3COO- в растворе, 1 л которого содержит 1 моль CH3COOH и 0,1 моля НСI, считая диссоциацию последнего полной.
Решение:
KD(CH3COOH) = 1.8 . 10-5.
Уравнения диссоциаций кислот имеют вид:
CH3COOH ⇔ CH3COO- + H+;
HCl⇔ Cl- + H+.
При введении в раствор слабого электролита CH3COOH раствора сильного электролита НСI (т.е. ионов H+), одинаковых ионов, образующихся при диссоциации уксусной кислот, равновесие диссоциации последней нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации слабого электролита уменьшится.
Таким образом, при прибавлении 0,1 М раствора НСI к 1 М раствору CH3COOH приведёт к повышению концентрации ионов водорода и, согласно правилу Ле Шателье, равновесие диссоциации сместится влево, в сторону увеличения концентрации молекул уксусной кислоты. Концентрацию ионов H+ и CH3COO- при диссоциации CH3COOH обозначим через x моль/л. Тогда концентрация недиссоциированных молекул CH3COOH будет равна (1 – x)моль/л. Общая концентрация ионов H+ будет слагаться из двух величин: из концентрации, создаваемой при диссоциации CH3COOH, и из концентрации, создаваемой при диссоциации НСI, т.е. (0,1 + x). Подставим полученные значения концентраций в выражение константы диссоциации CH3COOH, рассчитаем значение x, получим:
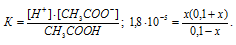
Поскольку в присутствии одноимённых ионов H+ диссоциация уксусной кислоты подавляется, то степень её диссоциации будет ничтожно мала и поэтому значением (x) в множителях (1 – x) и (1 + x) можно пренебречь. Тогда получим выражение:
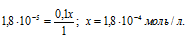
Ответ: 1,8 . 10-4 моль/л.
Задача 515.
Исходя из значений последовательных констант диссоциации ортофосфорной кислоты, определить знак изменения энергии Гиббса для каждой из трех ступеней диссоциации. Для какой из них  имеет наибольшее абсолютное значение?
имеет наибольшее абсолютное значение?
Решение:
Диссоциация трёхосновной ортофосфорной кислоты протекает в три ступени, поэтому для каждой ступени будет отвечать определённое значение константы диссоциации. Константы ступенчатых диссоциаций H3PO4 имеют следующие значения:
К1 = 7,5 . 10-3;
К2 = 6,3 . 10-8;
К3 = 1,3 . 10-12, т.е. К1 > K2 > K3.
Тогда из уравнения:
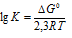
Отсюда вытекает:
 1 <
1 < 2 <
2 < 3 .
3 .
Все значения констант меньше единицы, значит, все значения  < 0. При этом наибольшее абсолютное значение
< 0. При этом наибольшее абсолютное значение  будет для третьей ступени.
будет для третьей ступени.
Ответ: Для третьей ступени.
Задача 516.
Раствор, содержащий 2,1г КОН в 250г воды, замерзает при -0,519°С. Найти для этого раствора изотонический коэффициент.
Решение:
Теперь определим понижение температуры кристаллизации  t(крист) раствора без учёта диссоциации щёлочи (криоскопическая константа для воды равна 1,86) по формуле:
t(крист) раствора без учёта диссоциации щёлочи (криоскопическая константа для воды равна 1,86) по формуле:
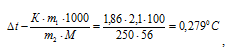
где
m1 - масса растворённого вещества, m2 - масса раствора, М – молярная масса растворённого вещества, К – криоскопическая константа.
Сравнивая найденное значение  t(теорет) с экспериментально полученным значением
t(теорет) с экспериментально полученным значением  t(экспер), рассчитаем изотонический коэффициент по формуле:
t(экспер), рассчитаем изотонический коэффициент по формуле:
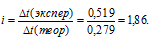
Ответ: 1,86.
Задача 517.
При 0 °С осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации в растворе.
Решение:
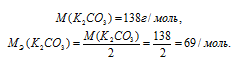
Найдём молярность 0,1 н раствора К2СО3 по формуле:
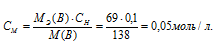
По уравнению  = СMRT рассчитаем теоретическое значение осмотического давления раствора:
= СMRT рассчитаем теоретическое значение осмотического давления раствора:
 (теорет) = 0,05 . 8,314 . 273 = 113,5 кПа.
(теорет) = 0,05 . 8,314 . 273 = 113,5 кПа.
Теперь рассчитаем изотонический коэффициент (i) раствора, сравнив экспериментальное значение осмотического давления с теоретическим значением, получим:
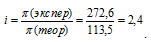
Рассчитаем кажущуюся степень диссоциации ( ) соли из соотношения:
) соли из соотношения:
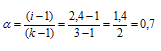
здесь
K - общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,7.

