Решение задач по химии на расчет убывания осмотического давления растворов
Задача 526.
Какое расположение 0,01 М растворов указанных ниже веществ соответствует убыванию осмотического давления?
а) СН3СООН - NaCl - C6H12O6 - CaCl2;
б) C6H12O6 - СН3СООН - NaCl _ CaCl2;
в) CaCl2 - NaCl - СН3СООН - C6H12O6;
г) CaCl2 - СН3СООН - C6H12O6 - NaCl.
Решение:
Осмотическое давление электролитов определяется по формуле  = iCMRT, т.е. при одинаковой концентрации растворов электролитов осмотическое давление будет тем больше, чем сильнее электролит, а, значит, чем больше его степень диссоциации и чем больше ио-нов образуется при диссоциации его. Изотонический коэффициент зависит от силы электролита, чем сильнее электролит, тем больше значение изотонического коэффициента, а также и от того, на какое количество ионов распадается электролит при диссоциации. Диссоциацию сильных электролитов принято считать равной единице. Диссоциация уксусной кислоты равна:
= iCMRT, т.е. при одинаковой концентрации растворов электролитов осмотическое давление будет тем больше, чем сильнее электролит, а, значит, чем больше его степень диссоциации и чем больше ио-нов образуется при диссоциации его. Изотонический коэффициент зависит от силы электролита, чем сильнее электролит, тем больше значение изотонического коэффициента, а также и от того, на какое количество ионов распадается электролит при диссоциации. Диссоциацию сильных электролитов принято считать равной единице. Диссоциация уксусной кислоты равна:
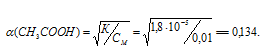
Рассчитаем изотонический коэффициент электролитов из формулы
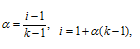
где
i - изотонический коэффициент,  - степень диссоциации электролита, k - число ионов, на которые распадается электролит.
- степень диссоциации электролита, k - число ионов, на которые распадается электролит.
Отсюда
i(CaCl2) = 1 +1(3 - 1) = 3;
i(NaCl) = 1 + 1(2 - 1) = 2;
i(CH3COOH) = 1 + 0,134(2 - 1) = 1,134.
Осмотическое давление C6H12O6, как неэлектролита, рассчитывается по формуле:
 = iCMRT
= iCMRT
Таким образом,
P(CaCl2) > P(NaCl) > P(СН3СООН) > P(C6H12O6).
Ответ: в).
Задача 527.
Указать правильное соотношение между температурами замерзания растворов цианида аммония NH4CN (t1) и уксусного альдегида CH3COO (t2), каждый из которых содержит 5 г растворенного вещества в 100 г воды: а) t1 = t2; 6) t1 > t2; в) t1 < t2.
Решение:
M(NH4CN) = 44 г/моль; М(CH3COO) = 44 г/моль.
Понижение температуры кристаллизации электролитов определяется по формуле:
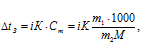
Где
i - изотонический коэффициент, К – криоскопический коэффициент (для воды равен 1,86), m1 и m2 - соответственно масса растворённого вещества и растворителя, М - молярная масса растворённого вещества.
Рассчитаем степень диссоциации цианида аммония по формуле:
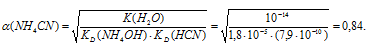
Изотонический коэффициент электролита связан со степенью диссоциации соотношением:
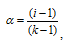
где
i - изотонический коэффициент,  - степень диссоциации электролита, k - число ионов, на которые распадается электролит.
- степень диссоциации электролита, k - число ионов, на которые распадается электролит.
Тогда
i - 1 + 0,84(2 = 1) = 1,84.
Теперь рассчитаем понижение температуры кристаллизации цианида аммония, получим:
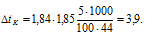
Понижение температуры кристаллизации неэлектролита рассчитаем по формуле:
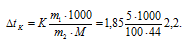
Находим температуры замерзания растворов:
- t1 = 0 - 3,9 = -3,9 °C; t2 = 0 - 2,2 = -2,2 °C. t1 > t2.
Ответ: в).
Задача 528.
Указать правильное соотношение между значениями стандартного изменения энергии Гиббса для процессов диссоциации воды  1 ) и уксусной кислоты
1 ) и уксусной кислоты  2 ): а)
2 ): а)  1 >
1 >  2; б)
2; б)  1 =
1 =  2; в)
2; в)  1 <
1 < 2.
2.
Решение:
KD(H2O) = 1 . 10-14; KD(CH3COOH) = 1,8 . 10-5.
Энергия Гиббса в стандартных условиях определяется по уравнению:
 = lgK . 5,69.
= lgK . 5,69.
Рассчитаем значения энергии Гиббса при диссоциации воды и уксусной кислоты:
 1 = -lg10-14 . 5,69 =
1 = -lg10-14 . 5,69 =
= 14 . 5,69 = 79,66 Дж;
 2 = -lg1,8 . 10-5) . 5,69 =
2 = -lg1,8 . 10-5) . 5,69 =
= 4,75 . 5,69 = 27,03 Дж.
79,66 > 27,03, значит,  1 >
1 >  2.
2.
Ответ: а).

