Получение сульфида железа (III) и окисление сульфата железа (II)
Способ получения сульфида железа (III)
Задача 1123.
Можно ли получить сульфид железа (III) взаимодействием: а) растворов FeCl3 и Н2S; б) растворов Fe(NO3)2 и (NH4)2S? Ответ обосновать.
Решение:
а) 2FeCl3 + 3H2S → Fe2S3↓ + 6HCl .
Реакция идет до конца, равновесие смещается в сторону образования продуктов, так. как. выпадает осадок Fe2S3, значит данную реакцию можно использовать для получения сульфида железа (III).
б) Fe(NO3)2 + (NH4)2S → (NH4)2SO4 + FeS↓.
При сливании растворов Fe2+ и сульфида аммония образуется осадок FeS, поэтому эту реакцию можно использовать для получения сульфида железа (II), а никак для сульфид железа (III).
Ответ: а.
Окисление сульфата железа (II) кислородом
Задача 1124.
В водном растворе сульфат железа (II) окисляется растворенным в воде кислородом с образованием основной соли. Написать уравнение протекающей при этом реакции.
Решение:
4FeSO4 + O2 + 2H2O = 4FeOHSO4.
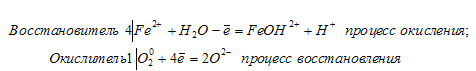
4Fe2+ + 4H2O + O20 =
= 4FeOH2+ + 4H+ + 2O2- (ионно-молекулярная форма);
или
4Fe2+ + 4H2O + O2 =
= 4FeOH2+ + 2Н2О (ионно-молекулярная форма);
4Fe2+ + 2H2O + O2 = 4FeOH2+ (ионно-молекулярная форма после приведения членов в равенстве).

