Смещение гидролиза соли в сторону усиления или уменьшения его
Задача 604.
Лакмус изменяет окраску в интервале рН от 5 до 8,3. Какова будет окраска содержащего лакмус 0,001 М раствора ацетата натрия CH3COONa (KГ = 5,6 . 10-9): а) красная; б) фиолетовая; в) синяя?
Решение:
KГ(CH3COONa) = 5,6 . 10-9.
CH3COO- + H2O ⇔ CH3COOH + OH-.
Находим степень гидролиза по формуле:
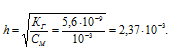
Далее определяем концентрацию ионов OH-:
[OH-] = h . CM =
= (2,37 . 10-3) . (10-3) =
= 2,37 . 10-6 моль/л.
Находим рН раствора:
pОH = -lgО[H-] =
= -lg2,37 . 10-6 =
= 6 - lg2,37 = 6 - 0,375 = 5,625;
рН = 14 - рОН =
= 14 - 5,625 = 8,3
Реакция среды будет щелочной (рН = 8,3), поэтому окраска лакмуса будет синей.
Ответ: в).
Задача 605.
Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале рН от 3,2 до 4,4. Какова будет окраска 0,1 М водного раствора ацетата аммония CH3COONH4, содержащего метиловый оранжевый: а) красная; б) оранжевая; в) желтая?
Решение:
CH3COONH4 - соль слабого основания и слабой кислоты, которая гидролизуется как по катиону, так и по аниону:
NH4+ + H2O ⇔ NH4OH + H+;
CH3COO- H2O ⇔ CH3COOH + OH-.
Так как константы диссоциации NH4OH и CH3COOH приблизительно равны 1,8 . 10-5, то соль будет в равной степени гидролизоваться и по катиону, и по аниону, образуя примерно равные количества ионов OH- и H+, реакция среды будет нейтральной, рН = 7.
Рассчитаем константу гидролиза:
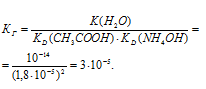
Теперь рассчитаем степень гидролиза:
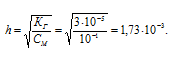
Находим концентрацию ионов H+ и OH-:
[H+] = [OH-] = h . CM =
= (1,73 . 10-3) . (0,1) = 1,73 . 10-4 г/моль.
Отсюда:
pH = lg [H+] =
= -lg1,73 . 10-4 =
= 4 - lg1,73 = 4 - 0,24 = 3,76 или 3,8.
Так как рН = 3,8, т. е. имеет промежуточное значение между 3,2 и 4,4, значит, окраска метилового оранжевого скорее будет оранжевой.
Ответ: б).
Задача 606.
Константы диссоциации азидоводорода HN3 и гидроксида аммония NH4OH примерно одинаковы. Каким будет соотношение значений рН в растворах NaN3 (pH1) и NH4NO3 (pH2 одинаковой молярной концентрации: а) pH1 > pH2; б) pH1 = pH2; в) pH1 < pH2?
Потому что: 1) обе соли гидролизуются в равной степени; 2) у одной соли гидролизуется катион, у другой - анион.
Решение:
а) NaN3 - соль сильного основания и слабой кислоты, которая гидролизуется по аниону:
N3- + H20 ⇔ HN3 + OH-.
При гидролизе данной соли образуется избыток ионов OH-, поэтому реакция среды будет щелочной, рН > 7.
б) NH4NO3 - соль слабого основания и сильной кислоты, которая гидролизуется по катиону:
NH4+ + H2O ⇔ NH4OH + H+.
При гидролизе данной соли образуется избыток иона H+, поэтому реакция среды раствора будет кислая, рН < 7.
Отсюда вытекает, что pH1 > pH2, потому что у NaN3 гидролизуется катион, а у NH4NO3 - анион.
Ответ: а2.
Задача 607.
Добавление каких из перечисленных ниже реагентов к раствору FeCl3 усилит гидролиз соли:
а) HCl; б) NaOH; в) ZnCl2; г) Na2CO3; д) NH4Cl; е) Zn; ж) H2O?
Решение:
FeCl3 - соль слабого основания и сильной кислоты гидролизуется по катиону:
Fe3+ + H2O ⇔ FeOH2+ + H+.
Гидролиз соли в основном протекает по первой ступени и при этом образуется избыток ионов водорода.
а) Если в раствор FeCl3 ввести раствор HCl, в растворе будет введено дополнительное количество ионов водорода (за счёт диссоциации кислоты HCl ⇔ H+ + Cl-), то, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения ионов водорода, т.е. в сторону ослабления гидролиза.
б) Если в раствор FeCl3 ввести дополнительное количество раствора NaOH, то ионы OH-, образующиеся при диссоциации щёлочи (NaOH ⇔ Na+ + OH-), будут связывать ионы H+, образующиеся при гидролизе FeCl3 в воду (H+ + OH- ⇔ H2O ). Поэтому, согласно принципу Ле Шателье, равновесие гидролиза FeCl3 сместится в сторону дополнительного образования ионов H+, т.е. гидролиз соли усилится.
в) Если в раствор FeCl3 ввести дополнительное количество раствора ZnCl2, гидролизующейся тоже по катиону, то в растворе будет образовываться дополнительное количество ионов H+. Согласно принципу Ле Шателье, равновесие в системе сместится в сторону уменьшения концентрации ионов H+, т.е. в сторону замедления гидролиза соли FeCl3.
г) Если в раствор FeCl3 ввести раствор Na2CO3, гидролиз которой проходит по аниону:
CO32- + H2O ⇔ HCO3- + OH-, то в растворе будет образовываться дополнительное количество ионов OH-, которые будут связываться с ионами H+, образуемыми при гидролизе соли FeCl3, с образованием молекул H2O (H+ + OH- ⇔ H2O ), что вызовет взаимное усиление гидролиза обеих солей и в результате – конечных продуктов гидролиза (образование нерастворимого Fe(OH)3 и выделение газообразного СО2):
2Fe3+ + 3CO32- + 3H2O ⇔
⇔ 2Fe(OH)3↓ + 3CO2↑;
2FeCl3 + 3Na2CO3 + 3H2O ⇔
⇔ 2Fe(OH)3↓ + 3CO2↑.
д) Если в раствор FeCl3 добавить раствор NH4Cl, гидролизующейся по катиону:
NH4+ + H2O⇔ NH4OH + H+, то в растворе будет происходить увеличение концентрации ионов H+, что, согласно принципу Ле Шателье, сместит равновесие системы в сторону уменьшения гидролиза FeCl3.
е) При добавлении в раствор FeCl3 гранул цинка произойдёт связывание ионов водорода. Объясняется это тем, что цинк как активный металл будет отдавать электроны ионам водорода, образующихся при гидролизе соли (Zn + 2H+ ⇔ Zn2+ + H2↑), что приводит к уменьшению концентрации ионов H+ в растворе. Согласно принципу Ле Шателье, равновесие системы сместится в сторону увеличения концентрации ионов H+, т.е. в сторону усиления гидролиза FeCl3.
ж) При добавлении воды в раствор соли FeCl3 будет происходить разбавление раствора, что будет способствовать уменьшению концентрации всех веществ, участвующих в гидролизе, это приведёт к нарушению равновесия в растворе. Для того чтобы равновесие восстановилось некоторое количество соли должно дополнительно гидролизоваться, т. е .разбавление раствора соли способствует усилению гидролиза – процесса, связанного с поглощением воды.
Ответ: б); г); е); ж).

