Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10-4.
KF - соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
F- + H2O ⇔ HF + OH-
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
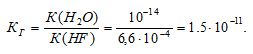
Степень гидролиза соли определяется по формуле:
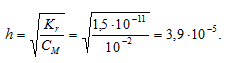
Здесь
KГ - константа гидролиза соли; h - степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH-:
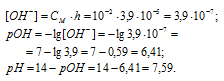
Ответ: КГ = 1,5 . 10-11; h = 3,9 . 10-5; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl - соль слабого основания и сильной кислоты гидролизуется по катиону:
NH4+ + H2O ⇔ NH4OH + H+
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
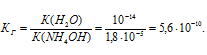
Степень гидролиза соли определяется по формуле:
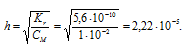
Здесь
KГ - константа гидролиза соли; h - степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов H+:
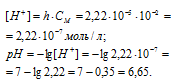
Ответ: КГ = 5,6 . 10-10; h = 2,4 . 10-4; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10-7.
Na2CO3 - соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
CO32- + H2O ⇔ HCO3- + OH-;
CM(Na2CO3) = 1/2 . CH(Na2CO3) =
= 1/2 . 0,02 = 0,01 моль/л.
Степень гидролиза соли определяется по формуле:
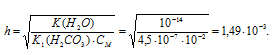
Здесь
h - степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH-:
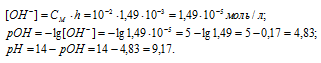
Ответ: pH = 9,17.

