Молекулярные и в ионно-молекулярные уравнения гидролиза солей
Задача 949.
Написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза Na2СО3, КНСО3, (NH4)2СO3. Указать реакцию среды.
Решение:
а) Na2CO3 – соль сильного основания и слабой кислоты, гидролизуется по аниону:
Na2CO3 (↔ 2Na+ + CO32- (уравнение диссоциации);
CO32- + H2O↔ HCO3–+ OH– (ионно-молекулярная форма);
Na2CO3 + Н2О ↔ NaHCO3 + NaOH (молекулярная форма).
При гидролизе соли образуется избыток ионов ОН–, которые придают раствору щелочную среду, рН > 7.
б) КНСО3 – кислая соль сильного основания и слабой кислотой гидролизуется по аниону:
КНСО3 ↔ К+ + НСО3– (уравнение диссоциации);
НСО3– + Н2О ↔ Н2СО3 + OH– (ионно-молекулярная форма);
КНСО3 + Н2О ↔ Н2СО3 + КОН (молекулярная форма).
При гидролизе соли образуется избыток ионов OH–, которые придают раствору щелочную среду, рН > 7.
в) (NH4)2СO3 – соль слабого основания и слабой кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2СO3 ↔ 2NH4+ + CO32- (уравнение диссоциации);
NH4+ + H2O ↔ NH4OH + H+ (ионно-молекулярная форма);
CO32- + H2O ↔ HCO3–+ OH– (ионно-молекулярная форма);
(NH4)2СO3 + Н2О ↔ NH4НСO3 + NH4ОН (молекулярная форма).
Гидролиз по аниону в основном протекает по 1-ой ступени. При гидролизе соли образуется дополнительное количество ионов Н+ и ОН-, которые связываясь образуют молекулы Н2О ↔ Н+ + ОН– ↔ Н2О. Раствор приобретает нейтральную среду, рН = 7. Но так как
КDII(H2CO3) < КD(NH4OH) или 4,7 . 10-11 < 1.8 . 10-5, то преимущественно будет протекать гидролиз соли по аниону и в растворе будет наблюдаться некоторый избыток ионов ОН-, что придаёт ему слабощелочную среду, рН > 7.
Задача 950.
Вычислить рН 0,01 М раствора карбоната калия.
Решение:
К2СО3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
К2СО3 ↔ 2К+ + CO32-;
CO32- + Н2О ↔ HCO3– + OH–.
Рассчитаем степень гидролиза соли:
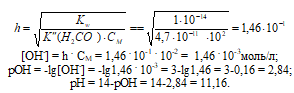
Ответ: рН = 11,16.
Задача 951.
Для получения соды раствор NаОН разделили на две равные порции, одну из них насытили СО2, после чего смешали с другой порцией. Какое вещество образовалось после насыщения первой порции? Какая реакция произошла при смешении первой порции со второй? Написать уравнения реакций.
Решение:
При насыщении раствора едкого натра углекислым газом образуется гидрокарбонат натрия:
NaOH + CO2 ↔ NHCO3.
При смешивании растворов NaOH и NaHCO3 произойдёт реакция в результате которой образуется Na2CO3:
NaOH + NaHCO3 ↔ Na2CO3 + H2O.

