Характеристика окислительно-восстановительных свойств диоксида серы и сернистой кислоты
Задача 859.
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами.
Решение:
Сера в SO2 и H2SO3 находится в своей промежуточной степени окисления +4, поэтому SO2 и H2SO3 могут проявлять как восстановительные, так и окислительные
свойства.
а) Сера как восстановитель
2SO2 + O2 ↔ 2SO3;
H2SO3 + Cl2 + H2O ↔ H2SO4 + 2HCl.
Здесь степень окисления серы повышается от +4 до +6.
б) Сера как окислитель
SO2 + 2H2S ↔ 3S↓ + 2H2O;
H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Здесь степень окисления серы понижается от +4 до 0.
Задача 860.
Закончить уравнения реакций:
а) H2S + SO2 ↔ ;
б) H2SO3 + I2 ↔ ;
в) KMnO4 + SO2 + H2O ↔ ;
г) HIO3 + H2SO3 ↔ .
Указать, какие свойства проявляют в каждой из этих реакций диоксид серы или сернистая кислота.
Решение:
а) H2S + SO2 ↔ 3S↓ + 2H2O
Уравнения ионно-молекулярного баланса:
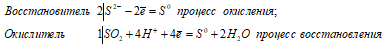
2S2- + SO2 + 4H+ = 3S0 + 2H2O
Молекулярная форма:
2H2S + SO2 = 3S↓ + 2H2O.
Таким образом, диоксид серы проявляет свойства окислителя, а сероводород - восстановителя.
б) H2SО3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
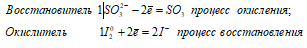
SO32- + I20 = SO3 + 2I-
Молекулярная форма:
H2SO3 + I2 = SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя.
в) 2KMnO4 + SO2 + 2H2O↔ 2MnO2↓ + K2SO4 + 3H2SO4
Уравнения ионно-молекулярного баланса:
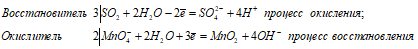
3SO2 + 2MnO4- + 10H2O = 3SO42- + 2MnO2 + 12H+ + 8OH-
Молекулярная форма:
2KMnO4 + SO2 + 2H2O ↔2MnO2↓ + K2SO4 + 3H2SO4
Таким образом, диоксид серы проявляет свойства восстановителя.
г) HIO3 + 3H2SO3 ↔ HI + 3H2SO4
Уравнения ионно-молекулярного баланса:
Восстановитель 3|6|SO32- + H2O - 2e = SO42- + 2H+ процесс окисления
Окислитель 1|2|IO3- + 6H+ + 6e = I- + 3H2O процесс восстановления
Ионно-молекулярное уравнение:
3SO32- + IO3- + 3H2O + 6H+ ↔
↔ 3SO42- + I- + 6H+ + 3H2O
Молекулярная форма:
HIO3 + 3H2SO3 ↔ HI + 3H2SO4
Таким образом, сернистая кислота проявляет свойства восстановителя.
Задача 861.
Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: Н2SO4(конц.), КОН(к.), Р2O5(к.), К2CO3(к.)?
Решение:
а) Н2SO4(конц.) бурно реагирует с водой с образованием гидратов, в основном моногидратов:
Н2SO4(конц.)+ nH2O ↔
↔ H2SO4 . nH2O.
б) SO2 как кислотный оксид реагирует с кристаллическим КОН с образованием кислой соли:
КОН(к) + SO2(г) ↔ КНSO3(к).
в) SO2 как кислотный оксид реагирует с кристаллическим К2СО3 с образованием соли сернистой кислоты и диоксида углерода:
К2СО3(к) + SO2(г) ↔
↔ КSO3(к) + СО2(г).
г) Р2О5 бурно реагирует с водой с образованием фосфорной кислоты:
Р2О5 + 3Н2О ↔ 2Н3РО4.
Таким образом, Н2SO4(конц.) и Р2О5 можно применить для осушения SO2.
Задача 862.
Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСIО3, чтобы восстановить 16,9 г ее до НСI?
Решение:
Уравнение реакции имеет вид:
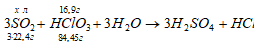
Рассчитаем объем SO2, необходимый для восстановления HCO3 из пропорции:
84,45 : (3 . 22,4) = 16,9 : x;
x = [16,9 . (3 . 22,4)]/84,45 = 13,45 л.
Ответ: V(SO2) = 13,45 л.

