Соединения меди и ее сплавы
Задание 405.
В присутствии влаги и диоксида углерода медь покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
Решение:
При обычной температуре медь очень слабо взаимодействует с кислородом воздуха в присутствии влаги и диоксида углерода, покрываясь зеленной плёнкой основной соли (основной карбонат меди) (CuOH)2CO3:
2Cu +O2 + H2O + CO2 = (CuOH)2CO3
Уравнения электронного баланса:
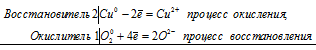
2Сu2+ + О20 = 2Cu2+ + 2О2-
Молекулярное уравнение реакции:
2Cu + О2 + СО2 + Н2О = (CuOH)2CO3
Если на эту соль подействовать раствором хлороводородной кислотой, то она растворится, и будут выделяться пузырьки газа:
(CuOH)2CO3 + 2HCl = 2CuCl2 + H2O + CO2↑
Плёнка зелёного цвета в виде зелёного налёта образуется на медных монетах, пролежавших долго в сыром месте. Очистить монету от зелёного налёта можно, протерев её ваткой, смоченной в растворе соляной кислоте.
Задание 406.
Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой - избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
Решение:
Латунь – сплав меди с цинком. При обработке латуни азотной кислотой в реакцию вступят цинк и медь. При этом образуются соответственно Zn(NO3)2, NH4NO3 и Cu(NO3)2, NO:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O;
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Если полученный раствор разделить на две части, и к одной из них прибавить избыток раствора аммиака, а к другой – избыток раствора щёлочи, то произойдут следующие реакции:
а) В первом растворе:
Zn(NO3)2 + 4NH3 = [Zn(NH3)4](NO3)2;
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2.
Таким образом, в первом растворе образуются растворимые комплексные соли цинка и меди. Комплексная соль [Cu(NH3)4](NO3)2 придаёт раствору ярко-синее окрашивание.
б) Во втором растворе:
Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3;
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O;
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Таким образом, во втором растворе образуется синий студёнистый осадок Cu(NO3)2 и белый осадок Zn(OH)2 и будет наблюдаться запах аммиака.

