Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
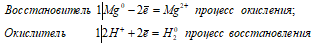
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
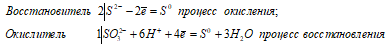
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
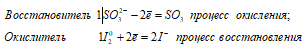
SO32- + I20 ↔ SO3 + 2I-
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
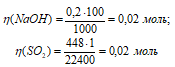
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Задача 865.
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔
↔ 2NaCl + 2SO2↑ + 2HCl.
Уравнения ионно-молекулярного баланса:
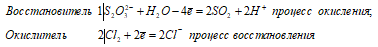
S2O32- + 2Cl20 + H2O ↔
↔ 2SO2↑ + 4Cl- + 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔
↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔
↔ 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
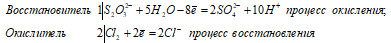
S2O32- + 4Cl20 + 5H2O ↔
↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔
↔ 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
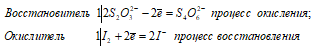
2S2O32- + I20 ↔ S4O62- + 2I-
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.

