Составление уравнений ионно-молекулярного баланса реакций межмолекулярного окисления-восстановления
Задача 614.
Какие из приведенных реакций относятся к реакциям межмолекулярного окисления-восстановления, к реакциям Реакции межмолекулярного окисления-восстановления и к реакциям диспропорционирования?
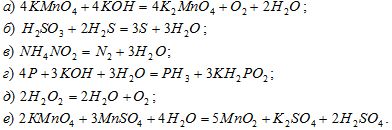
Решение:
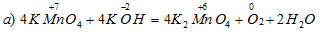
Уравнения ионно-молекулярного баланса:
Восстановитель 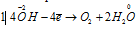 ; процесс окисления;
; процесс окисления;
Окислитель 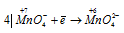 ; процесс восстановления.
; процесс восстановления.
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +6, а восстановителем является КОН, в котором кислород увеличивает свою степень окисленности от -2 до 0. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
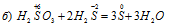
Уравнения ионно-молекулярного баланса:
Восстановитель 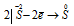 ; процесс окисления;
; процесс окисления;
Окислитель 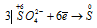 ; процесс восстановления.
; процесс восстановления.
В данной реакции сера в H2SO4 восстанавливается, изменяя степень окисленности от +6 до 0, а атом серы в H2S окисляется, потому что происходит увеличение степени окисленности от -2 до 0. Так как атомы, изменяющие свои степени окисленности, находятся в разных исходных веществах, то реакция относится к реакции межмолекулярного окисления-восстановления.
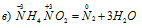
Уравнения ионно-молекулярного баланса:
Восстановитель 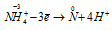 ; процесс окисления;
; процесс окисления;
Окислитель 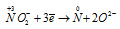 ; процесс восстановления.
; процесс восстановления.
В данной реакции атомы азота, находящиеся в нитрите аммония NH4NO2, изменяют свои степени окисленности один с -3 до 0, другой с +3 до 0. Процесс, в результате которого происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования).
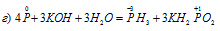
Уравнения электронного баланса:
Восстановитель 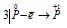 ; процесс окисления;
; процесс окисления;
Окислитель 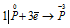 ; процесс восстановления.
; процесс восстановления.
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (фосфора), находящегося в одном веществе (Р).
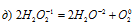
Уравнения электронного баланса:
Восстановитель 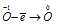 t; процесс окисления;
t; процесс окисления;
Окислитель 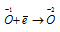 ; процесс восстановления.
; процесс восстановления.
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (кислорода), находящегося в одном веществе (пероксид водорода Н2О2).
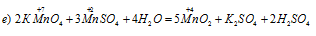
Уравнения ионно-молекулярного баланса:
Восстановитель 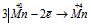 ; процесс окисления;
; процесс окисления;
Окислитель 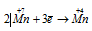 ; процесс восстановления.
; процесс восстановления.
Это реакция, в которой происходит выравнивание степеней окисленности атомов марганца от +7 и +2 до +4, т. е. наблюдается одновременно и увеличение, и уменьшение степеней окисления одного и того же вида атомов элемента, находящихся в различных соединениях, значит, реакция относится к межмолекулярной реакции окисления-восстановления.
Задача 615.
Указать, какие из перечисленных реакций относятся к окислительно-восстановительным:
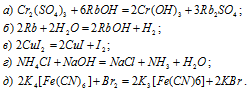
Решение:
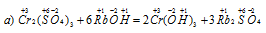
В данной реакции атомы элементов не изменяют свои степени окисленности, поэтому данная реакция не является окислительно-восстановительной.
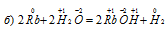
В данной реакции рубидий окисляется, увеличивая свою степень окисленности от 0 до +1, а водород в Н2О восстанавливается, уменьшая свою степень окисленности от +1 до 0, значит, реакция является окислительно-восстановительной.
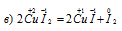
В данной реакции иод в CuI2 окисляется, увеличивая свою степень окисленности от -1 до 0, а медь в CuI2 восстанавливается, уменьшая свою степень окисленности от +2 до +1, значит, реакция является окислительно-восстановительной.
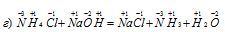
В данной реакции атомы элементов не изменяют свои степени окисленности, поэтому данная реакция не является окислительно-восстановительной.
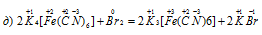
В данной реакции атомы железа окисляются, увеличивая свою степень окисленности от +2 до +3, а атомы брома в Br2 восстанавливается, уменьшая свою степень окисленности от 0 до -1, значит, реакция является окислительно-восстановительной.
Ответ: б), в), д).

