Роль пероксида водорода как окислителя и восстановителя в химических реакциях
Задача 632.
Закончить уравнения реакций, указать, какую роль играет в каждом случае пероксид водорода:
а) PbS + H2O2 →
б) HOCl + H2O2 → HCl +
в) KI + H2O2 →
г) KMnO4 + H2O2 → MnO2 +
д) I2 + H2O2 → HIO3 +
е) PbO2 + H2O2 → O2 +
Решение:
а) PbS + H2O2 →
Уравнения полуреакций:
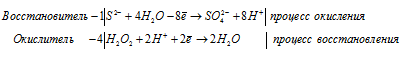
:
S2- + 4H2O2 + 4H2O + 8H+ =
= SO42- + 8H+ + 8H2O.
После приведения членов обеих частей уравнения, получим:
PbS + H2O2 = PbSO4 + 4H2O.
В данном процессе атом кислорода пероксида водорода понижает свою степень окисленности от -1 до -2, т.е. пероксид водорода – окислитель.
б) HOCl + H2O2 → HCl +
Уравнения полуреакций:
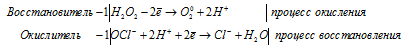
Ионно-молекулярная форма процесса:
H2O2 + OCl- + 2H+ = Cl- + O20 + 2H+ + H2O.
После приведения членов обеих частей уравнения, получим:
HOCl + H2O2 = HCl + O2 + H2O.
В данном процессе атом кислорода пероксида водорода повышает свою степень окисленности от -1 до 0, т.е. пероксид водорода – восстановитель.
в) KI + H2O2 →
Уравнения полуреакций:
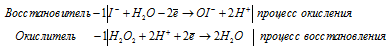
Ионно-молекулярная форма процесса:
I- + H2O2 + H2O + H+ = OI- + 2H+ + 2H2O.
После приведения членов обеих частей уравнения, получим:
KI + H2O2 = KOI + H2O.
В данном процессе атом кислорода пероксида водорода понижает свою степень окисленности от -1 до -2, т.е. пероксид водорода – окислитель.
г) KMnO4 + H2O2 → MnO2 +
Уравнения полуреакций:
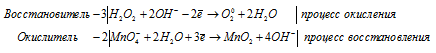
Ионно-молекулярная форма процесса:
3H2O2 + 2MnO4- + 6OH- + 4H2O =
= 2MnO2 + 3O20 + 6H2O + 8OH-.
После приведения членов обеих частей уравнения, получим:
2KMnO4 + 3H2O2 =
= 2MnO2 + 3O2 + 2KOH + 2H2O.
В данном процессе атом кислорода пероксида водорода повышает свою степень окисленности от -1 до 0, т.е. пероксид водорода – восстановитель.
д) I2 + H2O2 → HIO3 +
Уравнения полуреакций:
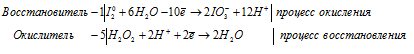
Ионно-молекулярная форма процесса:
I20 + 5H2O2 + 6H2O + 10H+ =
= 2IO3- + 12H+ + 10H2O.
После приведения членов обеих частей уравнения, получим:
I2 + 5H2O2 = 2HIO3 + 4H2O.
В данном процессе атом кислорода пероксида водорода понижает свою степень окисленности от -1 до -2, т.е. пероксид водорода – окислитель.
е) PbO2 + H2O2 → O2 +
Уравнения полуреакций:
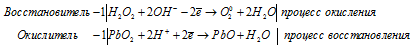
Ионно-молекулярная форма процесса:
H2O2 + PbO2 + 2OH- + 2H+ =
= O20 + PbO + 3H2O
После приведения членов обеих частей уравнения, получим:
PbO2 + H2O2 = O2 + PbO + H2O.
В данном процессе атом кислорода пероксида водорода повышает свою степень окисленности от -1 до 0, т.е. пероксид водорода – восстановитель.

