Составление уравнений реакций внутримолекулярного окисления-восстановления
Задача 635.
Закончить уравнения реакций внутримолекулярного окисления-восстановления. Какой атом или ион выполняет в каждом случае роль окислителя, какой — восстановителя?
а) CuI2 → CuI + I2
б) Pb(NO3)2 → PbO + NO2 +
в) KClO3 → KCl +
г) NH4NO2 → N2 +
д) KMnO4 → K2MnO4 + MnO2 +
Решение:
а) CuI2→ CuI + I2
Уравнения полуреакций:
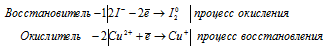
Ионно-молекулярная форма процесса:
2I- + Сu2+ → Cu+ I20
После приведения членов обеих частей уравнения, получим:
2CuI2 → 2CuI + I2
В данной реакции в CuI2 атомы йода увеличивают свою степень окисления от -1 до 0, проявляют свойства восстановителя, а атомы меди уменьшают свою степень окисления от +2 до +1, проявляют свойства окислителя.
б) Pb(NO3)2 → PbO + NO2 +
Уравнения полуреакций:
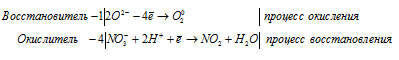
Ионно-молекулярная форма процесса:
2O2- + 4NO3- + 8H+ → O20 + 4NO2 + 4H2O.
После приведения членов обеих частей уравнения, получим:
2Pb(NO3)2 → 2PbO + 4NO2 + O2.
В данной реакции в Pb(NO3)2 атомы кислорода увеличивают свою степень окисления от -2 до 0, проявляют свойства восстановителя, а атомы азота уменьшают свою степень окисления от +5 до +4, проявляют свойства окислителя.
в) KClO3 → KCl +
Уравнения полуреакций:
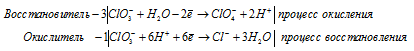
Ионно-молекулярная форма процесса:
4ClO3- + 3H2О + 6H+ →
→ ClO4- + Cl- + 3H2O + 6H+.
После приведения членов обеих частей уравнения, получим:
4KClO3 → KCl + 3KClO4.
В данной реакции в KClO3 часть атомов хлора увеличивает свою степень окисления от +5 до +6, проявляют свойства восстановителя, а другая часть атомов хлора уменьшает свою степень окисления от +5 до -1, проявляют свойства окислителя.
г) NH4NO2 → N2 +
Уравнения полуреакций:
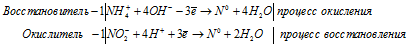
Ионно-молекулярная форма процесса:
NH4+ + NO2- + 4OH- + 4H+ → N20 + 6H2O.
После приведения членов обеих частей уравнения, получим:
NH4NO2 → N2 + 2H2O.
Среди внутримолекулярных окислительно-восстановительных реакций выделяют реакции конпропорционирования – процессы, в результате которых происходит выравнивание степени окисления атомов одного и того же элемента, находящегося в исходном веществе в различных состояниях. В данной реакции в NH4NO2 происходит выравнивание степеней окисления атомов азота. В исходном веществе существуют два атома азота с разными степенями окисления, один со степень окисления -3 (в ионе NH4+), другой со степенью окисления +3 (в ионе NO2-), в результате реакции образуется молекула азота N2, в которой атомы азота имеют степень окисления равную 0.
д) KMnO4 → K2MnO4 + MnO2 +
Уравнения полуреакций:
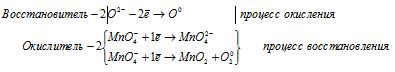
Ионно-молекулярная форма процесса:
2MnO4- + 2O2- → MnO42- + MnO2 + O2.
После приведения членов обеих частей уравнения, получим:
2KMnO4 → K2MnO4 + MnO2 + O2.
В данной реакции в KMnO4 атом марганца одновременно уменьшает степень окисления от +7 до +6 (при образовании К2MnO4) и от +7 до +4 (при образовании MnO2). Атом кислорода увеличивает степень окисления от-2 до 0 (при образовании О2). Таким образом, атомы кислорода проявляют свойства восстановителя, а атомы марганца – окислителя. Это типичная внутримолекулярная реакция самоокисления-восстановления.

