Вычисление концентрации ионов водорода и расчет рН раствора электролита
Задача 556.
Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13: а) 1013; б) 60,2 . 1013; в) 6,02 . 107; г) 6 ,02 . 1010?
Решение:
Согласно условию задачи -lg[H+] = 13, Следовательно, lg[H+] = -13 = 13. По таблице логарифмов находим [H+] = 1 . 10-13 моль/л.
Находим количество ионов водорода, содержащихся в 1 мл раствора из пропорции:
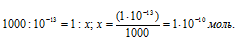
Известно, что один моль любого вещества содержит 6,02 . 1023 молекул. Тогда количество ионов водорода в 1 мл раствора находим из пропорции:
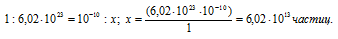
Ответ: б).
Задача 557.
Как изменится рН воды, если к 10 л ее добавить 10-2 моль NаОН; а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
Решение:
Рассчитаем молярную концентрацию полученного раствора по формуле:
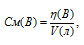
где
СМ(В) - молярная концентрация вещества В, моль/л; n(B) - количество растворённого вещества В, моль; V – объём раствора, л (мл).
Отсюда
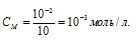
Едкий натр является сильным электролитом, поэтому степень диссоциации его можно считать равной единице. Тогда концентрация гидроксид-ионов в растворе будет равна концентрации самого электролита - 10-3 моль/л.
Теперь рассчитаем рОН раствора:
pOН = -lgOH=] = -lg10-3 =
= 3 + lg1 = 3 + 0 = 3.
Отсюда
pH = 14 - pOH = 14 - 3 = 11.
рН чистого раствора воды равна 7. Отсюда найдём разницу между рН чистой воды и рН раствора щёлочи:
pH(H2O) - pH(NaOH) = 11 - 7 = 4.
Таким образом, рН раствора увеличилась на 4.
Ответ: в).
Задача 558.
Чему равен рН нейтрального раствора при 50 °С: а) 5,5; б) 6,6; в) 7,0?
Решение:
 (H2O) = 55,81 кДж.
(H2O) = 55,81 кДж.
Количественно диссоциация воды описывается константой диссоциации:
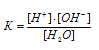
KW = [H+] . [OH-] = 10-14(при 22 °С).
Молярная концентрация воды в 1 л раствора рассчитаем из соотношения:
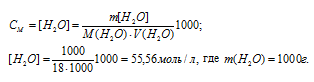
Константу диссоциации при температуре 22 °С рассчитаем, решив уравнение относительно ионного произведения воды:
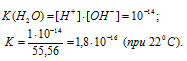
Зная константу равновесия при одной температуре можно рассчитать её значение при другой температуре из соотношения:
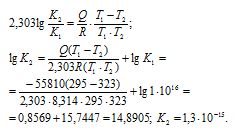
Подставив вычисленное значение К2 в уравнение ионного произведения воды, получим:
[H+] . [OH-] = K[H2O]; pH =
= 13 . 10-15 . 55,81 = 7,2 . 10-14.
Kp(H2O) = -lg7,2 . 10-14 =
= 14 - lg7,2 = 14 - 0,86 = 13,16.
Находим рН раствора из соотношения Kp(H2O) = pH + pOH и, учитывая, что в нейтральном растворе рН = рОН, получим:
13,16 = pH + pOH;
pH = 13,16/2 = 6,58 или 6,6.
Ответ: б).

