Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
Задача 634.
Закончить уравнения реакций самоокисления-самовосстановления (диспропорционирования):
а) I2 + Ba(OH)2 → Ba(IO3)2 +
б) K2SO3 → K2S +
в) HClO3 → ClO2 +
г) P2O3 + H2O → PH3 +
д) P + KOH + H2O → KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Решение:
Реакции диспропорционирования сопровождаются одновременным увеличением и уменьшением степени окисления одного и того же элемента, первоначально находившихся в одном, определённом состоянии.
а) I2 + Ba(OH)2 → Ba(IO3)2 +
Уравнения полуреакций:
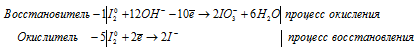
Ионно-молекулярная форма процесса:
6I20 + 12OH- → 2IO3- + 6H2O.
После приведения членов обеих частей уравнения, получим:
6I2 + 6Ba(OH)2 → 6Ba(IO3)2 + 6H2O.
б) K2SO3 → K2S +
Уравнения полуреакций:
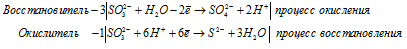
Ионно-молекулярная форма процесса:
4SO32- + 6H+ + H2O →
→ 4SO42- + S2- + 3H2O + 6H+
После приведения членов обеих частей уравнения, получим:
K2SO3→ 3K2SO4 + K2S
в) HClO3 → ClO2 +
Уравнения полуреакций:
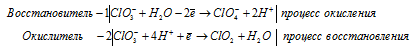
Ионно-молекулярная форма процесса:
3ClO3- + 2H+ + H2O →
→ ClO4- + 2ClO2 + 2H2O + 2H+.
После приведения членов обеих частей уравнения, получим:
3HClO3 → HClO4 + 2ClO2 + H2O.
г) P2O3 + H2O → PH3 +
Уравнения полуреакций:
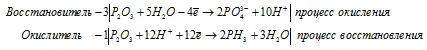
Ионно-молекулярная форма процесса:
4P2O3 + 12H+ + 15H2O →
→ 6PO43- + 2PH3 + 30OH- + 3H2O.
После приведения членов обеих частей уравнения, получим:
2P2O3 + 6H2O → 3H3PO4 + PH3
д) P + KOH + H2O → KH2PO2 + PH3
Уравнения полуреакций:
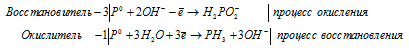
Ионно-молекулярная форма процесса:
4P0 + 6OH- + 3H2O →
→ 3H2PO2- + PH3 + 3OH-.
После приведения членов обеих частей уравнения, получим:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Уравнения полуреакций:
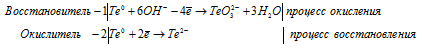
Ионно-молекулярная форма процесса:
3Te0 + 6OH- → TeO32- + 2Te2- + 3H2O.
После приведения членов обеих частей уравнения, получим:
3Te + 6KOH → K2TeO3 + 2K2Te + 3H2O.

