Составление уравнений реакций, характеризующих окислительно-восстановительную двойственность элементов
Задача 633.
Закончить уравнения реакций. Обратить внимание на окислительно-восстановительную двойственность элементов, находящихся в промежуточной степени окисленности:
а) KI + HNO2 + CH3COOH ⇒ NO +
KMnO4 + KNO2 + H2SO4 ⇒ KNO3 +
б) H2SO3 + Cl2 + H2O ⇒ H2SO4 +
H2SO3 + H2S ⇒ S +
в) Na2S2O3 + I2 ⇒ Na2S4O6 +
Cl2 + I2 + H2O ⇒ HIO3 +
Решение:
а)
1) KI + HNO2 + CH3COOH ⇒ NO +
Уравнения полуреакций:
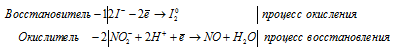
Ионно-молекулярная форма процесса:
2I- + 2NO2- + 4H+ = I20 + 2NO + 2H2O
После приведения членов обеих частей уравнения, получим:
2KI + 2HNO2 + 4CH3COOH = 2NO + I2 + 4CH3COOK + 2H2O.
2) KMnO4 + KNO2 + H2SO4 ⇒ KNO3 +
Уравнения полуреакций:
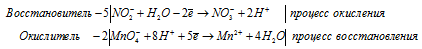
Ионно-молекулярная форма процесса:
5NO2- +2 MnO4- + 16H+ + 5H2O = 2Mn2+ + 5NO3- + 10H+ + 8H2O.
После приведения членов обеих частей уравнения, получим:
2KMnO4 + 5KNO2 + 3H2SO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O.
В KNO3 атом азота находится в своей промежуточной степени окисления +4, поэтому KNO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).
б)
1) H2SO3 + Cl2 + H2O ⇒ H2SO4 +
Уравнения полуреакций:
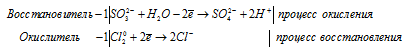
Ионно-молекулярная форма процесса:
SO32- + Cl20 + H2O = SO42- + 2Cl- + 2H+
После приведения членов обеих частей уравнения, получим:
H2SO3 + Cl2 + H2O = H2SO4 + 2HCl.
2) H2SO3 + H2S ⇒ S +
Уравнения полуреакций:
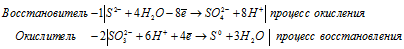
Ионно-молекулярная форма процесса:
2SO32- + S2- + 4H2O = SO42- + 2S0 + 8H+ + 6H2O.
После приведения членов обеих частей уравнения, получим:
2H2SO3 + H2S = 2S + H2SO4 + 2H2O.
В H2SO3 атом серы находится в своей промежуточной степени окисления +4, поэтому H2SO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 2), так и восстановителя (реакция 1).
в)
1) Na2S2O3 + I2 ⇒ Na2S4O6 +
Уравнения полуреакций:
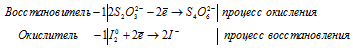
Ионно-молекулярная форма процесса:
2S2O32- + I20 = S4O62- + 2I-
После приведения членов обеих частей уравнения, получим:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI.
2) Cl2 + I2 + H2O ⇒ HIO3 +
Уравнения полуреакций:
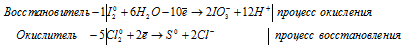
Ионно-молекулярная форма процесса:
5Cl20 + I20 + 6H2O = 2IO3- + 10Cl- + 12H+.
После приведения членов обеих частей уравнения, получим:
5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl.
В I2 атом йода находится в своей промежуточной степени окисления 0, поэтому I2 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).

