Последовательность выделения металлов при электролизе раствора их солей
Задача 692.
В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди?
Решение:
Стандартные электродные потенциалы систем:
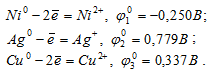
Следовательно,  02 >
02 > 03 >
03 >  01. Поэтому сначала будет выделяться серебро, затем, медь и только после этого никель.
01. Поэтому сначала будет выделяться серебро, затем, медь и только после этого никель.
Ответ: Ag, Cu, Ni.
Задача 693.
Раствор содержит ионы Fe2+, Ag+, Bi3+, Pb2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла?
Решение:
Стандартные электродные потенциалы систем
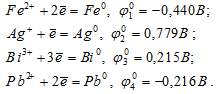
Следовательно,  02 >
02 >  03 >
03 >  04 >
04 >  01. Поэтому сначала будут выделяться ионы серебра, затем, висмута, свинца и только после этого железа.
01. Поэтому сначала будут выделяться ионы серебра, затем, висмута, свинца и только после этого железа.
Ответ: Ag+, Bi3+, Pb2+, Fe2+.
Задача 694.
Составить схему процессов, происходящих на медных электродах при электролизе водного раствора КNO3.
Решение:
Так как значение электродного потенциала системы K+ - 2 ⇔ K0 (-2,924 В) значительно ниже, чем потенциал водородного электрода в нейтральной среде 2H2O + 2
⇔ K0 (-2,924 В) значительно ниже, чем потенциал водородного электрода в нейтральной среде 2H2O + 2 ⇔ H2↑ + 2ОH- (-0,41 В), а значение электродного потенциала меди намного выше значений потенциалов калия и воды, то на катоде будет наблюдаться восстановление ионов меди:
⇔ H2↑ + 2ОH- (-0,41 В), а значение электродного потенциала меди намного выше значений потенциалов калия и воды, то на катоде будет наблюдаться восстановление ионов меди:
Cu2+ + 2 ⇔ Cu0.
⇔ Cu0.
Ионы меди будут приходить к катоду от анода, а ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление меди, так как электродный потенциал системы Cu0 - 2 ⇔ Cu2+ (+0,337 В) значительно ниже электродного потенциала системы 2H2O - 4
⇔ Cu2+ (+0,337 В) значительно ниже электродного потенциала системы 2H2O - 4 ⇔ O2↑ + 4Н+ (+1,228 В):
⇔ O2↑ + 4Н+ (+1,228 В):
Cu0 - 2 ⇔ Cu2+.
⇔ Cu2+.
Медь – материал анода будет растворяться, и накапливаться вместе с приходящими к аноду нитрат-ионами.
Таким образом, при электролизе раствора нитрата калия на медных электродах происходит растворение медного анода и осаждение чистой меди на медном катоде. Ионы калия и нитрат-ионы в процессе электролиза не участвуют, а являются средой для проведения электролиза и остаются в растворе. Следовательно, энергия электрического тока при этом электролизе расходуется на перенос меди с анода на катод. Данный процесс можно использовать для рафинирования меди очистка её от примесей. Медные пластины соединяют с источником постоянного тока таким образом, чтобы очищения медь была катодом, а неочищенная медь – анодом.
Задача 695.
Имеется раствор, содержащий КСI и Сu(NO3)2. Предложить наиболее простой способ получения практически чистого KNO3.
Решение:
Для получения практически чистого KNO3 из смеси КСI и Сu(NO3)2 можно предложить электрохимический метод, основанный на проведении электролиза данной смеси. Стандартный электродный потенциал системы: Cu2+ + 2 ⇔Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) и системы: K+ + 1
⇔Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) и системы: K+ + 1 ⇔ K0 (-2,924 В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
⇔ K0 (-2,924 В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Cu0 - 2 ⇔ Cu2+.
⇔ Cu2+.
Ионы калия будут накапливаться в катодном пространстве.
На аноде будет происходить электрохимическое окисление ионов хлора Cl-, не смотря на то, что стандартный электродный потенциал системы: Cl- - 2 ⇔ Cl* (1,359 В) менее положителен, чем системы:
⇔ Cl* (1,359 В) менее положителен, чем системы:
2H2O - 4 ⇔O2↑ + 4Н+ (1,228В):
⇔O2↑ + 4Н+ (1,228В):
2Cl- - 2 ⇔ 2Cl*; Cl + Cl* =Cl2.
⇔ 2Cl*; Cl + Cl* =Cl2.
Нитрат-ионы будут накапливаться в анодном пространстве. Сложив уравнения катодного и анодного процессов, получим суммарное уравнение электролиза:
Cu2+ + 2Cl- ⇔ Cu0 + Cl2↑
катод анод
Ионно-молекулярная форма процесса:
Cu(NO3)2 + 2KCl ⇔ Cu + 2K+ + Cl2↑ + 2NO3-
у катода у анода
Cu(NO3)2 + 2KCl ⇔Cu + Cl2↑ + 2КNO3
Таким образом, при электролизе смеси КСI и Сu(NO3)2 на катоде выделяется металлическая медь, а на аноде – газообразный хлор. Оставшиеся ионы калия и нитрат-ионы можно выделить в виде чистой кристаллической соли KNO3 методом выпаривания из раствора после проведения электролиза смеси солей.

