Расчет количества электричества, необходимое для электрохимического превращения одного эквивалента вещества
Задача 700.
Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
Решение:
Для расчета времени используем уравнение закона Фарадея:
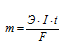
Здесь
m - масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса; I — сила тока; t - время; F - постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно времени и подставим данные задачи:
(m = M . n = 18 . 2 = 36,
I = 2A, Э = М/2 = 18/2= 9 г/моль):
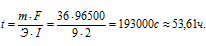
Ответ: 53,61ч.
Задача 701.
Как электролитически получить LiОН из соли лития? Какое количество электричества необходимо для получения 1 т LiОН? Составить схемы электродных процессов.
Решение:
Электролитически гидроксид лития можно получить из соли литя при электролизе её водного раствора. Например, при электролизе раствора соли LiCl. Стандартный электродный потенциал системы Li+ + 1 = Li0 (-3,045 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением газообразного водорода ионы лития будут накапливаться в катодном пространстве:
= Li0 (-3,045 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением газообразного водорода ионы лития будут накапливаться в катодном пространстве:
2H2O + 2 = H2↑ + 2OH-.
= H2↑ + 2OH-.
На аноде будет происходить электрохимическое окисление хлора, стандартный потеннциал которого (+1,36 В) выше, чем воды (+1,23 В). Хлор будет окисляться, потому что наблюдается значительное перенапряжение процесса окисления воды, материал анода оказывает тормозящее воздействие на его протекание:
2Cl- + 2 = 2Cl*;
= 2Cl*;
Cl* + Cl* = Cl2↑.
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение:
2H2O + 2Cl- = H2↑ + 2OH- + Cl2↑.
у катода у анода
Таким образом, одновременно с выделением газообразного водорода (катод) и газообразного хлора (анод), образуется гидроксид лития (катодное пространство).
Количество электричества (Q = It) находим по формуле:
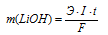
Здесь
Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Тогда
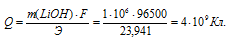
Ответ: 4 . 109 Кл.
Задача 702.
Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6 А в течение ЗО мин через водный раствор КОН.
Решение:
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следующей форме:
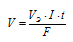
Здесь
V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль;
F - число Фарадея (96500 Кл/моль); t – время (для данного процесса равно 30 . 60 = 1800 с). Поскольку при нормальных условиях эквивалентный объем кислорода равен 5,6 л/моль, то получаем:
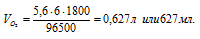
Ответ: 627мл.
Задача 703.
Найти объем водорода (условия нормальные), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор Н2SO4.
Решение:
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следующей форме:
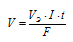
Здесь
V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль; F - число Фарадея (96500 Кл/моль); t – время (для данного процесса равно 60 . 60 = 3600 с). Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, то получаем:
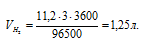
Ответ: 1,25 л.

