Химические свойства ванадия
Задание 407.
Ванадий получают алюминотермически или кальцийтермически восстановлением оксида ванадия(V) V2O5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
Решение:
1. Уравнения реакций получения ванадия
а) V2O5 + Al =Al2O3 +V
Уравнения электронного баланса:
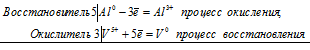
5Al0 + 3V5+ = 3Al3+ + 3V0
Для получения молекулярного уравнения необходимо ионно-молекулярное уравнение умножить на 2, получим:
3V2O5 + 10Al = 5Al2O3 +6V;
а) V2O5 + Са = СаО + V.
Уравнения электронного баланса:
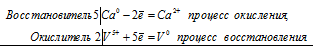
5Ca0 + 2V5+ = 5Cа2+ + 2V0.
Молекулярное уравнение реакции:
5Ca + V2О5 = 5CаО + 2V.
2. Уравнение реакции растворения ванадия в растворе щёлочи
Уравнения электронного баланса:
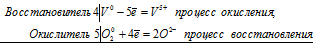
4V + 5О20 = 4V5+ + 10О2-
Молекулярное уравнение реакции:
4V + 5О20 + 4KOH = 4KVO3 + 2H2O
Задание 408.
Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения реакции.
Решение:
3. Уравнение реакции ванадия с азотной кислотой
Уравнения электронного баланса:
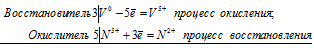
3V + 5N5+ = 3V5+ + 5N2+
Молекулярное уравнение реакции:
3V + 5HNO3 = 4HVO3 + 5NO + H2O
Задание 409.
Какую степень окисления проявляет ванадий в соединениях? Напишите формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислот-но-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: а) V2O3 с H2SO4; б) V2O5 с NаОН.
Решение:
Электронная конфигурация атома ванадия …3d34s2. Поэтому атомы ванадия могут отдавать два электрона с последнего уровня и три электрона – с предпоследнего, отсюда степень окисления ванадия может быть +2, +3, +4, +5. Наиболее устойчивы соединения ванадия со степенью окисления +5. Ванадий образует четыре оксида: VO, V2O3, VO2, V2O5. VO и V2O3 – основные оксиды, VO2 – амфотерный оксид, V2O5 – кислотный оксид. С повышением степени окисления атома ванадия кислотные свойства его оксидов усиливаются при переходе от низшей степени окисления к высшей степени окисления.
Уравнения реакций
а) V2O3 с H2SO4
Как основной оксид V2O3 реагирует с кислотами с образованием соответствующей соли и воды:
V2O3 + 3H2SO4 = V2(SO4)3 + 3H2O
б) V2O5 с NаОН
Как кислотный оксид V2O3 реагирует с основаниями, образуя различные ванадаты:
V2O5 + 6NaOH = 2Na2VO4 + 3H2O;
ортованадат натрия
V2O5 + 4NaOH = Na2V2O7 + 2H2O;
пированадат
натрия 3V2O5 + 6NaOH = 2Na3V3O9 + 2H2O.
триметаванадат
натрия
Задание 410.
При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (II). Составьте электронные и молекулярные уравнения реакции.
Решение:
Уравнение реакции цинка и метаванадата аммония
Уравнения электронного баланса:
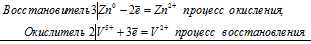
3Zn0 + 2V5+ = 3Zn2+ + 2V2+
Молекулярное уравнение реакции:
5Zn + 2NH4VО3 + H2SO4 = 3ZnSO4 + 2VSO4 + (NH4)2SO4 + 6H2O
Так как метаванадат аммония имеет жёлтую окраску, то при образовании в результате реакции сульфата ванадия (II) раствор станет фиолетовым.

