Химимческие и физические свойства фтороводорода и фторидов металлов
Задача 819.
В каких сосудах хранят водный раствор фтороводорода? Как называют такой раствор?
Решение:
Раствор фтороводорода в воде называют «плавиковой кислотой». Это название происходит от плавикового шпата – основного сырья для получения HF. Замечательным свойством фтороводорода и плавиковой кислоты является их способность взаимодействовать с оксидом кремния (IV), входящим в состав стекла, в результате чего образуется газообразный фторид фтора SiF4:
SiO2 + 4HF ↔ SiF4↑ + 2H2O.
В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами HF c образованием хорошо растворимой комплексной кремнефтороводородной кислоты:
SiF4 + 2HF ↔ H2[SiF6].
или уравнение реакции в общем виде:
SiO2 + 6HF ↔ H2[SiF6] + 2H2O.
Ввиду того, что Фтороводород разрушает стекло, поэтому в лаборатории его хранят в сосудах из свинца или стеклянных сосудах, покрытых изнутри слоем парафина, а также в сосудах из специальных сортов пластмасс.
Задача 820.
Какова реакция среды в водных растворах фторида натрия, фторида аммония, фторида кремния?
Решение:
а) Фторид натрия NaF – соль сильного основания (NaOH) и слабой кислоты (HF) гидролизуется по аниону:
NaF ↔ Na+ + F-;
F- + H2O ↔ HF + OH-.
или в молекулярной форме:
NaF + H2O ↔ F + NaOH.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, которые придают раствору щелочную реакцию, рН > 7.
б) Фторид натрия NH4F – соль слабого основания (NH4OH) и слабой кислоты (HF) гидролизуется как по катиону, так и по аниону:
NH4F ↔ NH4+ + F-;
NH4+ + H2O ↔ NH4OH +Н+;
F- + H2O ↔ HF + OH-.
или в молекулярной форме:
NaF + H2O ↔ HF + NaOH.
В процессе гидролиза NH4F в растворе образуются слабые электролиты (NH4OH и HF), а также ионы Н+ и ионы ОН-, которые соединяясь образуют воду
(Н+ + ОН- ↔ Н2О). При гидролизе соли, образованной слабой кислотой и слабым основанием, реакция раствора зависит от относительной силы кислоты и основания, образующих данную соль. Если KD(кислота) = KD(основание), то катион и анион гидролизуется в равной степени и реакция раствора будет нейтральной; если KD(кислота) > KDоснование), то катион соли гидролизуется в большей степени, чем анион, так что концентрация ионов Н+ в растворе будет больше, чем ионов ОН- и реакция среды будет слабокислой; наконец, если KD(кислота) < KD(основание), то гидролизу в большей степени подвергается анион соли и реакция раствора будет слабощелочной из-за образовавшегося избытка ионов ОН-.
Так как KD(NH4OH) = 1,79 . 10-8 < KD(HF) = 6,61 . 10-4, то гидролиз катиона NH4+ будет преобладать над гидролизом аниона F-, значит, в растворе соли будет наблюдаться некоторый избыток ионов водорода Н+, что придаст раствору слабокислотную среду, (рН > 7 или рН = 7).
в) Фторид кремния SiF4 в водных растворах подвергается гидролизу, в результате которого образуется фтористоводородная кислота (НF) и кремниевая кислота (H2SiO3):
SiF4 + 3H2O ↔ H2SO3 + 4HF↑.
Образующийся фтороводород взаимодействует SiF4. При этом получается гексафторкремниевая (или кремнефтористоводородная) кислота:
SiF4 + 2HF ↔ H2SiF6.
Суммарный процесс можно выразить уравнением:
3SiF4 + 3H2O ↔ 2H2SiF6 + H2SiO3.
В результате гидролиза фторида кремния образуются кислоты, поэтому реакция раствора будет кислой, рН < 7.
Задача 821.
Могут ли галогеноводороды в каких-либо реакциях играть роль окислителя? Дать мотивированный ответ.
Решение:
Поскольку галогенид-ионы не способны присоединять электроны, то в реакциях окисления-восстановления они могут играть только роль восстановителей, за исключением ионов F-, а ионы водорода способны присоединять электроны. Поэтому галогеноводороды за счёт ионов Н+ могут играть роль окислителя. Например, в реакциях с металлами ионы водорода, входящие в состав галогеноводорода, восстанавливаются последними до свободного водорода. При этом галгеноводороды могут реагировать только с металлами, стоящими в ряду напряжений до водорода, а точнее со всеми металлами, имеющими отрицательные стандартные потенциалы, Так цинк вытесняет водород из раствора соляной кислоты:
Электронные уравнения полуреакций:
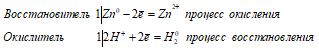
Zn0 + 2H+ ↔ Zn2+ + H2O;
Молекулярная форма:
Zn + 2HCl ↔ ZnCl2 + H2↑.
К реакциям, в которых галогеноводороды играют роль окислителя, относятся реакции термической диссоциации:
2HГ ↔ Г2 + Н2.
Задача 822.
Действием каких галогенов можно выделить свободный бром из растворов: а) бромида калия; б) бромата калия? Дать мотивированный ответ, используя данные таблицы стандартных электродных потенциалов.
Решение:
Электродный потенциал системы: Br2 + 2 = 2Br- равен 1,07 В (
= 2Br- равен 1,07 В ( 0(Red.)).
0(Red.)).
а) В бромиде калия степень окисления брома равна -1, поэтому бром в KBr только восстановителем, В растворе бромида калия бром может быть вытеснен окислителем, электродный потенциал которого значительно больше, чем у KBr. Так как электродный потенциал системы Cl2 + 2 = 2Cl- равен 1,36 В (
= 2Cl- равен 1,36 В ( 0(Ok.) ), то хлор может вытеснить бром из бромида калия (
0(Ok.) ), то хлор может вытеснить бром из бромида калия ( 0(Red.)) < (
0(Red.)) < ( 0(Ok.) ):
0(Ok.) ):
Cl2 + 2KBr = KCl + Br2.
б) В бромате калия KBrO3 степень окисления брома равна +5, поэтому он будет играть роль окислителя. Значит, электродный потенциал галогена, который вытеснит бром из бромата калия, должен быть меньше. Так как электродные потенциалы системы Г2 + 10 = 2Г+5 для брома хлора и йода, соответственно равны 1,52 В, 1,49 В и 1,19 В. Следовательно, восстановителем может быть йод:
= 2Г+5 для брома хлора и йода, соответственно равны 1,52 В, 1,49 В и 1,19 В. Следовательно, восстановителем может быть йод:
I2 + 2KBrO3 = 2KIO3 + Br2.

