Характеристика окислительно-восстановительных свойств пероксида водорода и гидразина
Задача 622.
Указать, в каких из следующих реакций пероксид водорода служит окислителем, а в каких - восстановителем:
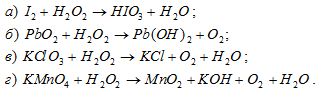
Решение:
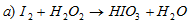
В данной реакции йод повышает свою степень окисления от 0 до +5, а кислород перекиси водорода понижает свою степень окисления от -1 до -2, т.е. перекись водорода - окислитель.
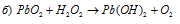
В данной реакции свинец понижает свою степень окисления от +4 до +2, а кислород перекиси водорода повышает от -1 до 0, т.е. пероксид водорода – восстановитель.
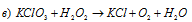
В данной реакции хлор понижает свою степень окисления от +7 до -1, а кислород перекиси водорода повышает от -1 до 0, т.е. пероксид водорода – восстановитель.
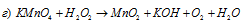
В данной реакции марганец понижает свою степень окисления от +7 до +4, а кислород перекиси водорода повышает от -1 до 0, т. е. пероксид водорода – восстановитель.
Задача 623.
Указать, в какой из приведенных реакций гидразин N2H4 служит окислителем, и в какой — восстановителем:
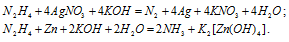
Как изменяется в каждом случае степень окисленности азота?
Решение:
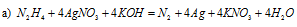
В данной реакции серебро понижает свою степень окисления от +1 до 0, а азот гидразина повышает от -2 до 0, т. е. гидразин – восстановитель.
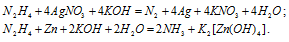
В данной реакции цинк повышает свою степень окисления от 0 до +2, а атом азота гидразина понижает свою степень окисления от -2 до -3, т. е. гидразин - окислитель.
Задача 624.
Составить уравнения полуреакций окисления и восстановления для следующих реакций и определить, в каких случаях водород служит окислителем и в каких восстановителем:
а) 2Al + 6HCl⇔ 2AlCl3 + 3H2↑;
б) 2H2 + O2 ⇔ 2H2O;
в) 2Na + 2H2O ⇔ 2NaOH + H2↑;
г) BaH2 + 2H2O ⇔ Ba(OH)2 + 2H2↑.
Решение:
а) 2Al + 6HCl ⇔2AlCl3 + 3H2↑
Уравнения полуреакций:
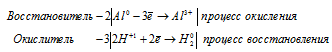
Водород восстанавливается, понижая свою степень окисления от +1 до 0, т. е. является окислителем.
б) 2H2 + O2 ⇔ 2H2O
Уравнения полуреакций:
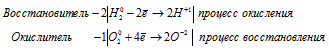
Водород окисляется, повышая свою степень окисления от 0 до +1, т. е. является восстановителем.
в) 2Na + 2H2O ⇔ 2NaOH + H2↑
Уравнения полуреакций:
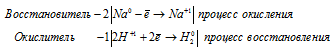
Водород восстанавливается, понижая свою степень окисления от +1 до 0, т. е. является окислителем.
г) BaH2 + 2H2O ⇔ Ba(OH)2 + 2H2↑.
Уравнения полуреакций:
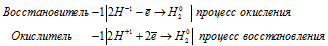
Водород гидрида бария окисляется, повышая степень окисления от -1 до 0, а водород во-ды – восстанавливается, понижая степень окисления от +1 до 0. Таким образом, водород в ВаН2 является восстановителем, а в Н2О – окислителем.

