Составление уравнений полуреакций окисления с учетом кислотности среды
Задача 625.
Составить уравнения полуреакций окисления с учетом кислотности среды:
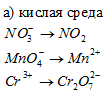 ;
;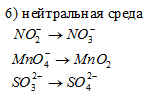 ;
; 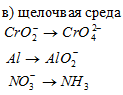 .
.
Решение:
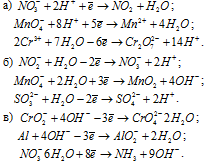
Задача 626.
Закончить уравнения реакций:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
б) MnO2 + O2 + KOH = K2MnO4 +
в) FeSO4 + Br2 + H2SO4 =
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Решение:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
Одна молекула Mn(OH)2 превращается в один ион Mn2+ и два иона OH-:
Mn(OH)2 = Mn2+ + 2OH-.
Источником кислорода для протекания процесса превращения Mn2+ в MnO2 служат ионы OH- в щелочной среде. Окислителем данного процесса являются атомы хлора из молекул Cl2.
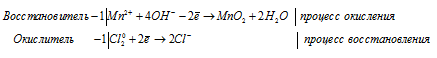
Ионно-молекулярная форма процесса:
Mn2+ + 4OH- + Cl20 =
= MnO2 + 2H2O + 2Cl-
Mn(OH)2 + Cl2 + 2KOH =
= MO2 + 2KCl + 2H2O.
б) MnO2 + O2 + KOH = K2MnO4 +
Марганец повышает свою степень окисления от +4 до +6, т. е. проявляет свойства восстановителя, а кислород понижает свою степень окисления от 0 до -2, проявляя свойства окислителя.
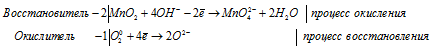
Ионно-молекулярная форма процесса:
2MnO2 + 8OH- + O20 =
= 2MnO42- + 4H2O + 2O2-
Молекулярная форма процесса:
2MnO2 + O2 + 8KOH =
= 2K2MnO4 + 2K2O + 4H2O.
в) FeSO4 + Br2 + H2SO4 =
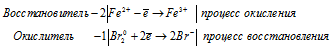
Ионно-молекулярная форма процесса:
2Fe2+ + Br20 = 2Fe3+ + 2Br-
Молекулярная форма процесса:
2FeSO4 + Br2 + H2SO4 =
= Fe2(SO4)3 + 2HBr
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
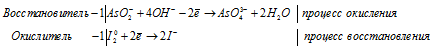
Ионно-молекулярная форма процесса:
AsO2- + I20 + 4OH- =
= AsO43- + 2I- + 2H2O
Молекулярная форма процесса:
NaAsO2 + I2 + 4NaOH =
= Na3AsO4 + 2NaI + 2H2O.

