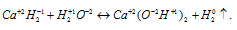Физические и химические свойства водорода
Задача 789.
Можно ли осушить водород концентрированной серной кислотой?
Решение:
Серная кислота является водоотнимающим средством в химической промышленности. Она способна образовывать с водой ряд кристаллогидратов, наиболее стойким из которых является Н2SO4 . H2O. Серная кислота жадно поглощает воду из смеси газов, поэтому часто применяется для осушения различных газовых систем. Концентрированная серная кислота является очень сильным окислителем, поэтому она будет окислять водород до ионов водорода, а сама восстанавливаться до сернистого газа:
Электронные уравнения процесса:
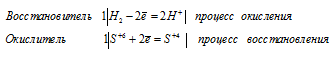
H2 + S+6 = 2H+ + S+4;
H2 + H2SO4 = SO2 + 2H2O.
Таким образом, концентрированная серная кислота окисляет молекулярный водород и, поэтому не может быть использована для осушения газообразного водорода.
Задача 790.
Как отличить водород от кислорода, диоксида углерода, азота?
Решение:
В присутствии кислорода тлеющая лучинка загорается, а если к сосуду с водородом поднести спичку, то раздаётся характерный звук (если водород чистый, то звук "глухой", а если с примесью кислорода - звук "лающий"). При поднесении спички к сосуду с диоксидом углерода она потухает, а если пропустить диоксид углерода через гидроксид кальция то появится помутнение. Азот как и диоксид углерода не горит (тушит зажжённую лучину), но не мутит известковой воды.
Задача 791.
Как проверить полученный в лаборатории водород на чистоту?
Решение:
Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее, то будет слышен характерный хлопок. (если водород чистый, то звук "глухой", а если с примесью кислорода - звук "лающий"). Дальнейшие опыты с водородом можно проводить только в том случае, если он чистый. проверка на чистоту нужна, чтобы исключить наличие в смеси кислорода или воздуха, если этого не сделать, то возможен взрыв, так как водород является горючим веществом, смеси водорода с воздухом с объемной долей водорода от 4 до 74 процентов взрывоопасны.
Задача 792.
Указать различия в свойствах атомарного и молекулярного водорода. Одинаковы ли теплоты сгорания атомарного и молекулярного водорода? Ответ обосновать.
Решение:
Молекулярный водород состоит из двухатомных молекул Н2 или Н : Н, атомарный водород из отдельных атомов (Н или Н .). Чтобы молекулярный водород вступил в какую-либо реакцию, молекулы его сперва должны распасться на атомы для чего необходимо затратить большое количество энергии. При реакции же атомарного водорода такой затраты энергии не требуется, так как атомарный водород уже находится в активном состоянии.
Действительно атомарный водород уже при комнатной температуре восстанавливает многие оксиды металлов, непосредственно соединяется с серой, азотом и фосфором. С кислородом атомарный водород образует пероксид водорода Н2О2. Атомарный водород способен вытеснять медь, серебро, свинец и некоторые другие малоактивные металлы из их солей, а молекулярный – не способен к такой реакции.
При горении молекулярного водорода образуется вода, а при горении атомарного - пероксид водорода:
H2 + 1/2O2 = H2O;
Н + O2 = 1/2H2O.
Из уравнений реакций горения следует, что теплоты сгорания их не равнозначны, так как неравнозначны теплоты образования Н2О и Н2О2. Теплота сгорания 1 моля Н2 равна численно теплоте образования 1 моля Н2О (-241,98 кДж/моль), а теплота сгорания 1 моль Н. – равна 1/2 моль теплоте образования Н2О2 (-187,9/2 кДж/моль).
Задача 793.
Охарактеризовать окислительно-восстановительные свойства молекул и ионов водорода. Привести примеры реакций.
Решение:
а) В молекуле водорода Н2 атом водорода имеет степень окисления 0, т.е. содержит один электрон. Поэтому водород в молекуле Н2 может как отдать, так и присоединить по одному электрону, превратившись при этом соответственно, в катион (Н+) или в анион (Н-). Таким образом, молекулярный водород может проявлять как восстановительные, так и окислительные свойства, изменяя при этом степень окисления от 0 до +1 или от 0 до -12.
Водород как восстановитель:
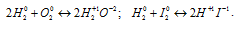
Водород как окислитель:
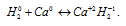
б) Катион водорода (Н+) представляет собой просто протон, поэтому способен только присоединять электрон, превращаясь при этом в нейтральный атом водорода (Н), т. е. способен проявлять только восстановительные свойства. Например, в разбавленной серной кислоте катион водорода является окислителем:
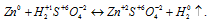
в) Анион водорода (Н-) содержит два электрона (1s2), водород в нём находится в своей степени окисления равной -1. Поэтому анион (Н-) теоретически способен отдать один или оба электрона, превратившись при этом в нейтральный атом (Н) или в катион( Н+). Таким образом, анион (Н-) является восстановителем в окислительно-восстановительных процессах: