Гидриды металлов, получение и свойства
Задача 794.
Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
Решение:
Соединения водорода с металлами называют гидридами. Гидриды металлов получают при нагревании металла в струе водорода. Гидриды имеют ионное строение, так металл кальций входит в состав СаН2 в виде иона Са2+, а водород – в виде аниона Н-. Таким образом, можно сделать вывод, что гидриды – солеподобные соединения.
а) При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид кальция:
Са + Н2 → СаН2.
б) Гидрид кальция СаН2 – солеподобное вещество белого цвета, которое гидролизуется как соль сильного основания и слабой кислоты по аниону:
СаН2 + 2Н2О → Са(ОН)2 + 2Н2↑.
Эта реакция может служить удобным методом для получения водорода в лабораторных условиях. Гидрид кальция можно использовать в качестве эффетивного осушителя воздушных, газовых и жидких неводных смесей, а также для количественного определения содержания воды в органических соединениях и кристаллогидратах и т.д. СаН2 служит для обнаружения следов воды.
Задача 795.
Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов СаН2 придется израсходовать для наполнения аэростата объемом 500 м3 (считая условия нормальными)? Сколько потребуется для этой цели цинка и серной кислоты?
Решение:
а) Уравнение реакции имеет вид:
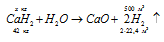
Молекулярная масса СаН2 равна 42 а. е. м., значит, СаН2 – 42 кг/кмоль. Массу СаН2 находим из пропорции:
х : 500 = 42 : 44,8;
х = (42 . 500)/44,8 = 468,75 кг.
б) Уравнение реакции имеет вид:
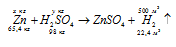
M(H2SO4) = 98 г/моль,
М(Zn) = 65,4 г/моль.
Массу цинка находим из пропорции:
х : 500 = 65,4 : 22,4;
х = (65,4 . 500)/22,4 = 1459,82 кг.
Массу серной кислоты находим из пропорции:
у : 500 = 98 : 22,4;
х = (98 . 500)/22,4 = 2187,50 кг.
Ответ: m(CaH2) = 468,75кг, m(Zn) = 1459,82кг, m(H2SO4) = 2187,50кг.
Задача 796.
Почему водород и кислород не взаимодействуют при обычной температуре, а при 700 °С реакция протекает практически мгновенно?
Решение:
Атомы водорода в молекуле Н2 и атомы кислорода в молекуле О2 соединены между собой очень прочными ковалентными связями. Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Поэтому любое столкновение между молекулами Н2 и О2 при обычной температуре и атмосферном давлении оказывается неэффективным. И только при повышении температуры, когда кинетическая энергия сталкивающихся молекул Н2 и О2 делается большой, некоторые соударения молекул Н2 и О2 становятся эффективными и приводят к образованию активных центров, что даёт начало реакции взаимодействия водорода с кислородом, т. е. реакция инициируется, и скорость её резко возрастает. При смешивании водорода и кислорода в отношении 2 : 1 можно получить взрыв, если инициировать реакции, например ударом. При 300 °С в смеси Н2 и О2 через несколько дней образуется немного Н2О, а при 500 °С водород полностью соединяется с кислородом за несколько часов, при нагревании смеси до 700 °С происходит быстрый подъём температуры и реакция заканчивается со взрывом. Поэтому чтобы взорвать смесь Н2 и О2 нужно подогреть её до 700 °С хотя бы в одном месте.

