Характеристика соединений элементов главной подгруппы VI группы
Задача 840.
Исходя из строения атомов серы, селена и теллура, указать, какие валентные состояния и степени окисленности характерны для этих элементов. Каковы формулы их высших гидроксидов? Ответ пояснить.
Решение:
Атомы S, Se и Te на внешнем энергетическом уровне содержат по шесть электронов (ns2р4) – два на s-орбитали и четыре на р-орбитали. Графически это можно представить так:
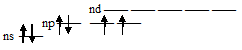
Поэтому в стационарном состоянии эти элементы, имея по два неспаренных р-электрона, проявляют ковалентность равную 2. У S, Se и Te число неспаренных электронов в атоме может быть увеличено путём перевода s- и р-электронов на d-подуровень внешнего слоя. В связи с этим, указанные элементы проявляют ковалентность, равную не только 2, но также и 4, и 6. Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность равную 4. Графически это можно представить так:
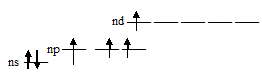
путём перевода, при возбуждении атома, р- и s-электронов на d-подуровень внешнего слоя, что приводит к образованию шести неспаренных электронов у атома во внешнем электронном слое. В связи с этим, указанные элементы проявляю ковалентность равную 6. Графически это можно представить так:
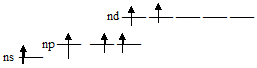
Таким образом, S, Se и Te в своих соединениях могут проявлять как отрицательную (-2), так и положительную степень окисления (+2, +4 и 6). В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами – она может быть +4 и +6. Поэтому в соединениях с кислородом данные элементы могут проявлять степень окисления равную как +4, так и +6, при этом образуются два вида оксидов с формулой.
Задача 841.
Дать сравнительную характеристику водородных соединений элементов главной подгруппы VI группы, указав и объяснив характер изменения: а) термической устойчивости; б) температур плавления и кипения; в) кислотно-основных и окислительно-восстановительных свойств. Какие из этих соединений могут быть получены взаимодействием водорода с соответствующим простым веществом?
Решение:
а) Прочность химической связи в молекулах водородных соединений элементов главной подгруппы VI группы падает в ряду - H2O — H2S — H2Se — H2Te, что проявляется изменении энтальпии диссоциации молекул на атомы. Причины этого заключаются в том, что с увеличением размеров внешних электронных облаков атомов степень их перекрывания уменьшается. Поэтому при переходе от Н2О к Н2Те уменьшается степень перекрывания электронных облаков атомов водорода и атома элемента главной подгруппы VI группы, а область перекрывания располагается на большем расстоянии от ядра атома элемента (О, S, Se, Te) и сильнее экранируется возросшим числом промежуточных электронных слоёв. Кроме того, в ряду O — S — Se — Te электроотрицательность атома элемента уменьшается. Поэтому в молекуле Н2О электронное облако атома водорода смещается в сторону атома кислорода в наибольшей степени, а в молекулах Н2S. H2Se и Н2Те – всё меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы падает устойчивость к нагреванию в ряду H2O — H2S — H2Se — H2Te.
б) В ряду H2O — H2S — H2Se — H2Te температуры кипения и плавления изменяются весьма закономерно, они в данном ряду плавно возрастают, тогда как при переходе к Н2О – они резко возрастают. Это обусловлено ассоциацией молекул воды в результате возникновения между ними водородных связей.
Закономерное возрастание температур плавления и кипения в ряду H2O — H2S — H2Se — H2Te объясняется увеличением радиусов атомов с возрастанием порядкового номера элемента. При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н2О).
в) Кислотные свойства в ряду: H2O — H2S — H2Se — H2Te закономерно усиливаются. Вода имеет очень маленькую степень диссоциации, потому что молекулы её образуют ассоциаты за счёт водородных связей, так что диссоциация молекулы Н2О требует значительной затраты в энергии. Поэтому вода типичный слабый электролит-амфолит, молекулы которого распадаются на ионы:
Н2О ↔ Н+ + ОН-.
H2O, H2S, H2Se, H2Te – типичные кислоты. Кислотные свойства в ряду закономерно усиливаются. Объясняется это тем, что в пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. При переходе от H2S к H2Te уменьшается степень перекрывания электронных облаков атомов водорода с атомами S, Se и Те, а сама область перекрывания электронных облаков располагается на большем расстоянии от ядра атома элемента и сильнее экранируется возросшим числом промежуточных слоёв. Кроме того, в ряду S — Se — Te электроотрицательность атомов уменьшается. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков, и тем самым, к ослаблению связи между атомами. Таким образом, в ряду H2S — H2Se — H2Te расстояние между атомами элемента и атомами водорода увеличивается, поэтому при растворении в воде их диссоциация по кислотному типу возрастает. Окислительная активность в ряду H2O — H2S — H2Se — H2Te последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду , что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель. В ряду H2O — H2S — H2Se — H2Te усиливаются восстановительные свойства. При действии сильных окислителей они окисляются до диоксидов или до соответствующих кислот состава H2RO3 или даже до H2RO4.
Вода и сероводород могут быть получены непосредственным взаимодействием водорода с кислородом или серой при достаточно высоких температурах. H2Se и H2Te получают косвенным путём, например, действием на селениды или теллуриды сильными кислотами:
Na2Se + H2SO4 = Na2SO4 + H2Se;
Na2Te + H2SO4 = Na2SO4 + H2Te.
Задача 842.
Какое вещество легче окисляется: сульфид натрия или теллурид натрия? Ответ пояснить.
Решение:
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. Поэтому ион Те2- будет легче отдавать электроны, чем ион S2-. Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем. Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.

