Строение и химические свойства озона. Применение озона
Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
Электронное строение трёхатомной молекулы озона можно представить схемой:
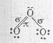
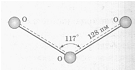
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная - пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 1170, что указывает на то, что, центральный атом кислорода находится в состоянии sp2 – гибридизации. Гибридная sp2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ - связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ - связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ - связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
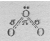
Рис.3. Структура молекулы О3
или
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
2KI + H2O + O3 = I2 + 2KOH + O2.
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
3О2 = 2О3, ΔН0 = -285кДж.
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
2Н2(г) + О2(г) = 2Н2О(г), ΔН0 = -285,8 кДж.
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG0 < O, что указывает на возможность протекания реакции в при стандартных условиях. Но в обычных условиях реакция кислорода с водородом практически не протекает. Малая скорость взаимодействия кислорода с водородом обусловлена высокой энергией активации данного процесса. Молекулы кислорода и водорода очень прочны; любое столкновение между ними при комнатной температуре, оказывается не эффективным. Лишь при повышенных температурах, когда кинетическая энергия сталкивающихся молекул делается большой, некоторые соударения молекул становятся эффективными и приводят к образованию активных центров. Применение высоких температур способствует к увеличению скорости данной реакции. При 300 0С реакция протекает со скоростью в несколько дней, а при 500 0С кислород и водород полностью прореагируют за несколько часов, при 700 0С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0С):
N2 + O2 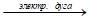 2NO.
2NO.
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН0298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
3О2 ↔ 2О3.
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5;
х = (2 . 0,5)/1 = 1л.
Находим ΔН0 реакции:
ΔН0 х.р. = 2 ΔН0 (O3) - 3 ΔН0 (O2) =
= (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х;
х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.

