Три вида межмолекулярного взаимодействия
Задача 279.
Какова природа сил Ван-дер-Ваальса? Какой вид взаимодействия между частицами приводит к переходу в конденсированное состояние Не, N2, НI, С12, ВF3, Н2O?
Решение:
В веществах с молекулярной структурой, а также в инертных газах, проявляются силы межмолекулярного взаимодействия – силы Ван-дер-Ваальса. Они слабее сил, приводящих к образованию ковалентной связи, но проявляются они на больших расстояниях.
Различают три вида межмолекулярного взаимодействия: ориентационное, индукционное и дисперсионное.
а) Ориентационные силы возникают между молекулами с постоянными электрическими дипольными моментами, т.е. между молекулами, у которых есть положительный и отрицательный полюса. Электростатические силы стремятся расположить молекулы упорядоченно так, чтобы векторы электрических дипольных моментов были ориентированы вдоль одной прямой.
В конденсированном состоянии молекулярные диполи ориентируются друг относительно друга противоположно заряжёнными полюсами, вследствие чего и наблюдается их взаимное притяжение. Так полярные молекулы Н2О в конденсированном состоянии ориентируются друг относительно друга противоположно заряжёнными полюсами:
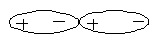
Такое же взаимодействие наблюдается и между молекулами HI, хотя молекула HI – слабый диполь. Молекула HI имеет очень большую деформируемость, поэтому внешние электроны атома йода крупные и поэтому ориентационное взаимодействие очень малое, будут наблюдаться дисперсионные силы межмолекулярного взаимодействия.
б) Индукционные силы взаимодействия возникают между молекулами с дипольным моментом равным нулю, но при этом способных поляризоваться. Причина появления индуцированных диполей обычно состоит в том, что каждый атом создаёт вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется, и образовавшийся индукционный диполь в свою очередь поляризует соседние молекулы. В результате происходит взаимное притяжение молекул друг к другу. Такое индукционное взаимодействие наблюдается и у веществ с полярными молекулами, но притяжение при этом значительно слабее ориентационного. Так в неполярной молекуле BF3 наблюдается возникновение индуцированных диполей.
в) Дисперсионные силы межмолекулярного взаимодействия имеют место во всех веществах, находящихся в конденсированном состоянии. Возникают они из-за того, что в атомах происходит движение электронов, а также колебание ядер, и связанное с этим непрерывное изменение взаимного положения электронов и ядер вызывает появление мгновенных диполей. При этом в твёрдом или жидком состоянии вещества ближайшие участки соседних молекул относительно друг друга оказываются заряжёнными электричеством противоположного знака, что приводит к их притяжению. Действием дисперсионных сил объясняется переход N2, Cl2 и Не в жидкое состояние.
Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества. Чем больше полярность молекул, тем больше ориентационные силы. Чем больше деформируемость, чем слабее связаны внешние электроны атомов, тем значительнее дисперсионные силы.
Таким образом, ориентационные силы межмолекулярного взаимодействия преобладают в относительно сильно поляризованных молекулах Н2О. В слабополяризованной, но сильно деформированной молекуле HI будут преобладать дисперсионные силы межмолекулярного взаимодействия над ориентационными силами. В молекуле HI на долю ориентационных сил межмолекулярного взаимодействия приходится 0,1%, а на долю дисперсионных сил – 99,5%.
Индукционные силы взаимодействия преобладают в молекулах BF3. В молекулах N2 и Cl2 преобладают дисперсионные силы взаимодействия. В Не дисперсионное взаимодействие является единственным взаимодействием между атомами, которое приводит к его конденсации.
Задачи 280.
Температуры кипения ВF3, ВСI3, ВВг3 и ВI3 соответственно равны 172, 286, 364, 483 К. Объяснить наблюдаемую закономерность.
Решение:
С ростом порядковых номеров галогенов увеличиваются размеры из атомов при сохранении аналогичной структуры внешнего слоя атомов и ионов. Поэтому поляризуемость атомов возрастает в ряду I, Cl, Br, F вследствие чего возрастают и силы дисперсионного взаимодействия между молекулами борогалогена. Отрыв молекул друг от друга, происходящий при переходе вещества в конденсированное состояние, требует большей затраты энергии, что и приводит к повышению температуры кипения в ряду веществ ВF3, ВСI3, ВВг3, ВI3.
Задача 281.
Температуры кипения NF3, РF3 и AsF3 соответственно равны 144, 178, 336 К. Объяснить наблюдаемую закономерность.
Решение:
Азот, фосфор и мышьяк имеют аналогичную структуру внешнего электронного слоя атомов ns2np3. С ростом порядкового номера в подгруппе атомов элементов увеличиваются размеры их радиусов. Поэтому поляризуемость атомов возрастает в ряду N, P, As вследствие чего возрастают и силы дисперсионного взаимодействия между молекулами вещества. Отрыв молекул друг от друга, происходящий при переходе вещества в конденсированное состояние, требует большей затраты энергии, что и приводит к повышению температуры кипения в ряду веществ NF3, РF3, AsF3.
Задача 282.
Ниже приведены температуры кипения Ткип., теплоты испарения  исп. и дипольные моменты
исп. и дипольные моменты 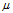 D в некоторых рядах сходных соединений:
D в некоторых рядах сходных соединений:
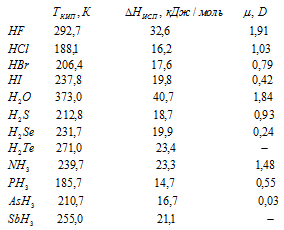
Объяснить, почему в каждом ряду соединений при монотонном изменении полярности молекул, Ткип. и  исп. изменяются немонотонно.
исп. изменяются немонотонно.
Решение:
В рядах сходных соединений наблюдается рост порядкового номера атомов элементов. С ростом порядкового номера элементов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы дисперсионного взаимодействия между молекулами веществ. Отрыв молекул друг от друга, происходящий при переходе вещества из жидкого состояния в газообразное состояние, требует всё большей затраты энергии. Это и приводит к повышению температуры кипения и энтальпии испарения веществ в каждом из рядов веществ.
Монотонность повышения Ткип. и  исп. при монотонном изменении полярности молекул в каждом ряду веществ нарушается из-за того, что атомы фтора, кислорода и азота обладают высокой электроотрицательностью и при этом образуют сильно полярные вещества. Благодаря высокой электроотрицательности эти элементов вещества HF, H2O и NH3 могут образовывать водородные связи, которые дополнительно упрочняют связь этих молекул в жидком состоянии, потому что к энергии дисперсионного взаимодействия между молекулами дополнительно присоединяется энергия водородных связей между ними. При переходе веществ в конденсированное состояние дополнительная затрата энергии на разрыв водородных связей. Благодаря разнице электроотрицательностей между атомами водорода и сурьмы (0,29) между молекулами SbH3 действуют более значительные силы (ориентационные) межмолекулярного взаимодействия, что и объясняет большее значение и этого вещества по сравнению с арсином и фосфином.
исп. при монотонном изменении полярности молекул в каждом ряду веществ нарушается из-за того, что атомы фтора, кислорода и азота обладают высокой электроотрицательностью и при этом образуют сильно полярные вещества. Благодаря высокой электроотрицательности эти элементов вещества HF, H2O и NH3 могут образовывать водородные связи, которые дополнительно упрочняют связь этих молекул в жидком состоянии, потому что к энергии дисперсионного взаимодействия между молекулами дополнительно присоединяется энергия водородных связей между ними. При переходе веществ в конденсированное состояние дополнительная затрата энергии на разрыв водородных связей. Благодаря разнице электроотрицательностей между атомами водорода и сурьмы (0,29) между молекулами SbH3 действуют более значительные силы (ориентационные) межмолекулярного взаимодействия, что и объясняет большее значение и этого вещества по сравнению с арсином и фосфином.

