Номенклатура и способы получения минеральных солей
Задача 159.
Составить формулы нормальных и кислых солей калия и кальция, образованных: а) угольной кислотой; б) мышьяковистой кислотой.
Решение:
а) Соли угольной кислоты Н2СО3:
К2СО3- карбонат калия; КНСО3 - гидрокарбонат калия; СаСО3 - карбонат кальция; СаНСО3 - гидрокарбонат кальция.
б) Соли мышьяковистой кислоты H3As2O3:
K3As2O3 - ортоарсенит (арсенит) калия; KH2As2O3 - дигидроортоарсенит (дигидроарсенит) калия; K2HAs2O3 - гидроарсенит (гидроарсенит) калия; Ca3As2O3 - ортоарсенит (арсенит) кальция; Ca(H2As2O3)2 - дигидроортоарсенит (дигидроарсенит) кальция; CaHAs2O3 - гидроортоарсенит (кидроарсенит) кальция.
Задача 160.
Назвать соли: SbONO3, [Fe(OH)2]2CrO4, (AlOH)SO4, Cd(HS)2, Ca(H2PO4)2.
Решение:
SbONO3 - нитрат стибрила (антимонила); [Fe(OH)2]2CrO4 - хромат дигидроксожелеза(III); (AlOH)SO4 - сульфат гидроксоалюминия; Cd(HS)2 - гидросульфид кадмия; Ca(H2PO4)2 - дигидроортофосфат кальция.
Задача 161.
При взаимодействии каких веществ можно получить дигидроортоантимонат натрия, метахромит натрия, гидроортоарсенат калия, сульфат гидроксоалюминия? Составить уравнения реакций.
Решение:
а) Дигидроортоантимонат натрия NaHSbO4 можно получить действием на раствор ортосурьмяной (сурьмяной) кислоты гидроксидом натрия NaOH:
HSbO4 + NaOH = NaHSbO4 + H2O.
б) Метахромит NaCrO2 натрия можно получит сплавлением оксида хрома (III) с оксидом натрия или едким натром:
Cr2O3 + Na2O = 2NaCrO2;
Cr2O3 + NaOH = 2NaCrO2 + H2O.
в) Гидроортоарсенат KHASO4 калия можно получить при действии мышьяковой кислоты на гидроксид калия :
H3ASO4 + 2KOH = KHAsO4 + 2H2O.
г) Сульфат гидроксоалюминия (AlOH)SO4 можно получить действием на гидроксид алюминия раствором серной кислоты:
Al(OH)3 + H2SO4 = (AlOH)SO4 + 2H2O.
Задача 162.
Написать уравнения реакций образования Mg2P2O7, Ca3(PO4)2, Mg(ClO4)2, Ba(NO3)2 в результате взаимодействия: а) основного и кислотного оксидов; б) основания и кислотного оксида; в) основного оксида и кислоты; г) основания и кислоты.
Решение:
1. Уравнения реакций получения Mg2P2O7:
а) из основного и кислотного оксидов:
MgO + P2O5 = Mg2P2O7.
б) из основания и кислотного оксида:
Mg(OH)2 + P2O5 = Mg2P2O7 + H2O.
в) из основного оксида и кислоты
2MgO + H4P2O7 = Mg2P2O7 + 2H2O.
г) из основания и кислоты:
2Mg(OH)2 + H4P2O7 = Mg2P2O7 + 4H2O.
2. Уравнения реакций образования Ca3(PO4)2:
а) из основного и кислотного оксидов:
CaO + P2O5 = Ca3(PO4)2.
б) из основания и кислотного оксида:
3Ca(OH)2 + P2O5 = Ca3(PO4)2 + 3H2O.
в) из основного оксида и кислоты:
2CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O.
г) из основания и кислоты:
2Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O.
3. Уравнения реакций получения Mg(ClO4)2:
а) из основного и кислотного оксидов:
MgO + Cl2O7 = Mg(ClO4)2.
б) из основания и кислотного оксида:
Mg(OH)2 + Cl2O7 = Mg(ClO4)2 + H2O.
в) из основного оксида и кислоты:
MgO +2HClO4 = Mg(ClO4)2 + H2O.
г) из основания и кислоты:
Mg(OH)2 +2HClO4 = Mg(ClO4)2 + 2H2O.
4. Уравнения реакций образования Ba(NO3)2:
а) из основного и кислотного оксидов:
BaO + N2O5 = Ba(NO3)2.
б) из основания и кислотного оксида:
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O.
в) из основного оксида и кислоты:
BaO + 2HNO3 + Ba(NO3)2 + H2O.
г) из основания и кислоты:
Ba(OH)2 + 2HNO3 + Ba(NO3)2 + 2H2O.
Задача 163.
Написать уравнения реакций, с помощью которых можно получить в лаборатории следующие вещества: а) хлороводород; б) сульфид свинца; в) сульфат бария; г) ортофосфат серебра; д) гидроксид железа (III) е) нитрат меди (II).
Решение:
а) В лаборатории хлороводород HCl можно получить действием концентрированной серной кислоты на твёрдый хлорид натрия:
2NaCl(кристал.) + H2SO4 =
= Na2SO4 + 2HCl.
б) При сливании растворов сероводорода и нитрата свинца образуется малорастворимый сульфид свинца PbS чёрного цвета. Поэтому раствор соли свинца (II) используется для обнаружения сероводорода. Бумажка, смоченная раствором соли свинца (II), быстро темнеет, если в воздухе присутствует даже незначительное количество сероводорода:
Pb(NO3)2 + H2S = PbS↓ + 2HNO3.
в) В лаборатории сульфат бария BaSO4 можно получить при сливании растворов хлорида бария и сульфата калия:
BaCl2 + K2SO4 = BaSO4↓ + 2KCl.
Раствор BaCl2 служит для качественного и количественного определения сульфат-ионов SO42-. При наличии в растворе сульфат-ионов при приливании хлорида бария выпадает белый рыхлый осадок сульфата бария, нерастворимый ни в воде, ни в кислотах.
г) В лаборатории ортофосфат серебра Ag3PO4 можно получить при сливании растворов ортофосфата кальция и нитрата серебра, при этом образуется осадок:
Ca3(PO4)2 + 6AgNO3 =
= 2Ag3PO4↓ + 3Ca(NO3)2.
д) Гидроксид железа (III) Fe(OH)3 в лаборатории можно получит при сливании растворов хлорида железа (III) и гидроксида натрия, при этом выпадает осадок:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
е) Нитрат меди (II) в лаборатории можно получить при растворении гидроксида меди (II) раствором азотной кислоты:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O.
Задача 164.
Назвать соли:
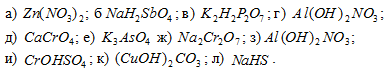
Решение:


