Вычисление приближенного значения активности ионов в растворе электролита
Задача 529.
Вычислить приближенное значение активности ионов K+ и SO42- в 0,01 М растворе K2SO4.
Решение:
Уравнение диссоциации K2SO4 имеет вид:
K2SO4 ⇔ 2K+ + SO42-.
Активность иона  (моль/л) связана с его молекулярной концентрацией в растворе соотношением:
(моль/л) связана с его молекулярной концентрацией в растворе соотношением:  = fCM.
= fCM.
Здесь f - коэффициент активности иона (безразмерная величина), СМ – концентрация иона. Коэффициент активности иона зависит от заряда иона и ионной силы раствора, которая равна полусумме произведений концентрации каждого иона на квадрат заряда иона:
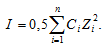
Ионная сила раствора равна:
I = 0,5[CM(2K+) . 12 + CM(SO42-) . 22] =
= 0,5(0,02 . 12) + (0,01 . 22) = 0,03.
Коэффициент активности ионов K+ и SO42- найдём по формуле, получим:
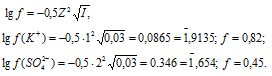
Теперь рассчитаем активность ионов K+ и SO42- из соотношения  = fCM получим:
= fCM получим:
 (K+) = 0,02 . 0,82 = 0,0164 моль/л;
(K+) = 0,02 . 0,82 = 0,0164 моль/л;  (SO42-) =
(SO42-) =
= 0,01 . 0,45 = 0,0045 моль/л.
Ответ:  (K+) = 0,0164 моль/л;
(K+) = 0,0164 моль/л;  (SO42-) = 0,0045 моль/л.
(SO42-) = 0,0045 моль/л.
Задача 530.
Вычислить приближенное значение активности ионов Ba2+ и Cl- в 0,002 н. растворе BaCl2.
Решение:
M(BaCl2) = CЭ(BaCl2)
СМ = СН = 2 . 0,002 = 0,004 моль/л.
Уравнение диссоциации хлорида бария имеет вид:
BaCl2 ⇔ Ba2+ + 2Cl- .
Активность иона  (моль/л) связана с его молекулярной концентрацией в растворе соотношением:
(моль/л) связана с его молекулярной концентрацией в растворе соотношением:  = fCM.
= fCM.
Здесь f - коэффициент активности иона (безразмерная величина), СМ – концентрация иона. Коэффициент активности иона зависит от заряда иона и ионной силы раствора, которая равна полусумме произведений концентрации каждого иона на квадрат заряда иона:
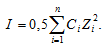
Ионная сила раствора равна:
I = 0,5[CM(Ba2+) . 22 + CM(Cl-) . 12] =
= 0,5(0,004 . 22) + (0,008 . 12) = 0,024.
Коэффициент активности ионов Ba2+ и Cl– найдём по формуле, получим:
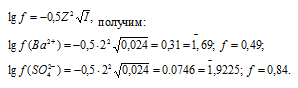
Теперь рассчитаем активность ионов Ba2+ и Cl- из соотношения  = fCM получим:
= fCM получим:
 (Ba2+) = 0,004 . 0,49 = 0,0196 моль/л;
(Ba2+) = 0,004 . 0,49 = 0,0196 моль/л;  (Cl-) =
(Cl-) =
= 0,008 . 0,84 = 0,00672 моль/л.
Ответ:  (Ba2+) = 0,0196 моль/л;
(Ba2+) = 0,0196 моль/л;  (Cl-) = 0,00672 моль/л.
(Cl-) = 0,00672 моль/л.
Задача 531.
Найти приближенное значение коэффициента активности иона водорода в 0,0005 М растворе H2SO4, содержащем, кроме того, 0,0005 моль/л НСI. Считать, что серная кислота полностью диссоциирует по обеим ступеням.
Решение:
Общая концентрация ионов водорода составляет сумму от концентрации H2SO4 и концентрации НСI. Кислоты диссоциируют по схеме:
H2SO4 ⇔ 2H+ + SO42-;
HCl ⇔ H+ + Cl-
Из уравнений вытекает, что концентрация ионов водорода в серной кислоте в 2 раза выше, чем кислоты и составит: 2 . 0,0005 = 0,001 моль/л. Общая концентрация ионов водорода в растворе составит:
0,001 + 0,0005 = 0,0015 моль/л.
Коэффициент активности иона рассчитывается по формуле:
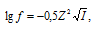
где f - коэффициент активности иона (безразмерная величина), I - ионная сила раствора, Z - заряд иона. Ионная сила раствора рассчитаем по уравнению:
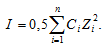
Здесь концентрация иона в растворе, получим:
I = 0,5[CM(H+) . 12 + CM(SO42-) . 22 + CM(Cl-) . 1 =
= 0,5[(0,0015 . 12) + (0,0005 . 22) + (0,0005 . 12)] =
= 0,002.
Рассчитаем коэффициент активности иона водорода:
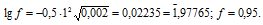
Ответ: 0,95.

