Каковы химические свойства азотной кислоты и "царской водки"
Задача 907.
Закончить уравнения реакций:
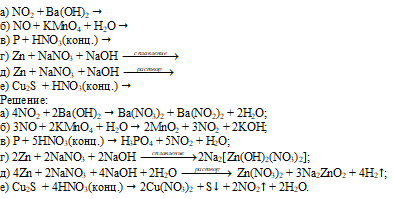
Задача 908.
Что называют царской водкой? Какими свойствами она обладает? Написать уравнение реакции взаимодействия царской водки с золотом.
Решение:
Смесь, состоящая из 1 объёма азотной кислоты и 3-4 объёмов соляной кислоты, называются «царской водкой». «Царская водка» растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила:
HNO3 + 3HCl = Cl2 + NOCl + 2H2O.
хлорид
нитрозила
Хлорид нитрозила является промежуточным продуктом реакции:
2NO + Cl2 = 2NOCl.
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность «царской водки». Реакция окисления золота и платины протекает в основном согласно следующим уравнениям:
Au + 4HNO3 + 3HCl =
= AuCl3 + NO↑ + 2H2O;
3Pt + 4HNO3 + 12HCl =
= 3Pt + 4 NO↑ + 8H2O.
Задача 909.
Требуется растворить некоторое количество меди в азотной кислоте. В каком случае расход азотной кислоты будет меньше — при применении 90% или 35%-ного (по массе) раствора HNO3?
Решение:
Уравнения реакций взаимодействия азотной кислоты с медью имеют вид:
а) Cu + 4HNO3(конц.) =
= Сu(NO2)2 + 2NO2↑ + 2H2O;
б) 3Cu + 8HNO3(разб.) =
= 3Сu(NO2)2 + 2NO↑ + 4H2O.
Из уравнений реакций следует, что на 1 моль Сu затрачивается 4 моль концентрированной (90%) HNO3 и 8/3 моль разбавленной (35%) HNO3, значит, на растворение меди разбавленной азотной кислоты требуется меньше, чем концентрированной.
Задача 910.
Как получить NH4NO3, воспользовавшись в качестве исходных веществ атмосферным азотом и водой?
Решение:
При некотором повышении температуры и давления в системе, состоящей из атмосферного воздуха и паров воды, возможно получение аммиачной селитры:
2N2(г) + O2(г) + 4Н2О(г) = 2NH4NO3(к); - Q.
Реакция эндотермическая и протекает с уменьшением объёма (с уменьшением числа газообразных продуктов), поэтому, согласно принципу Ле Шателье, возможно смещение равновесия в системе вправо при повышении температуры и давления. Такой метод получения аммиачной селитры в промышленности не используется, так как не рентабельный.

