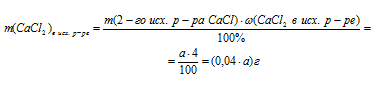Задача на определение массы использованного раствора
Задача 1.
К 300,0 г 20% -ного раствора нитрата серебра постепенно добавляли 4% раствор хлорида кальция до тех пор, пока массовая доля АgNO3 в растворе не стала равной 5%. Определите массу использованного раствора СаС12.
Дано:
масса 1 исходного раствора нитрата серебра: mисх.р-ра(АgNO3) = 300 г;
массовая доля АgNO3 в 1-м исходном р-ре:  %(АgNO3)в 1 исх. р-ре = 20%;
%(АgNO3)в 1 исх. р-ре = 20%;
массовая доля АgNO3 в конечном р-ре: % ( АgNO3)в кон. р-ре = 5%;
% ( АgNO3)в кон. р-ре = 5%;
массовая доля СаС12 во 2-м исходном р-ре:  %(СаСl2)во 2 исх. р-ре = 4%.
%(СаСl2)во 2 исх. р-ре = 4%.
Найти:
массу 2-го исходного раствора хлорида кальция: m2-го исх.р-ра(СаС12) = ?
Решение:
В условии описана химическая реакция обмена:
2АgNО3 +СаС12 = Са(NO3)2 + 2AgCl↓
Ситуация осложняется тем, что хлорид серебра выпадает в осадок. Таким образом, масса конечного раствора будет складываться из масс исходных растворов без массы выпавшего в осадок АgСl:
mкон. р-ра =
= m1 исх. р-pа(АgNО3) + m2 исх. р.ра(СаС12) – m(АgС1)
Из формулировки условия также понятно, что исходный нитрат серебра расходуется не весь. Часть АgNO3 остается в избытке.
Для решения используем встречный алгоритм. Искомой величиной является масса 4% раствора СаС12. Ее и обозначим величиной «а»: m2исх. р-ра(СаС12) = а г.
1. Определим массу чистого хлорида кальция в «а» г 4%-ного исходного раствора.
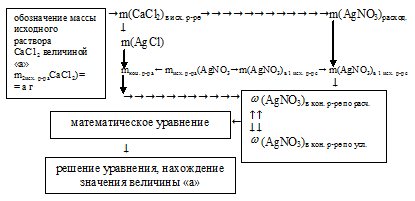
2. По уравнению реакции, используя значение m(СаС12) как известное, определим массу выпавшего осадка и расходовавшегося нитрата серебра:
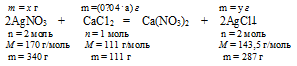
Составляем пропорции:
х г АgNО3 взаимодействуют с (0,04 . а) г СаС12 (по условию);
340 г АgNО3 взаимодействуют с 111 г СаС12 (по уравнению);
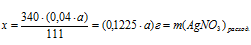
(0,04 . а) СаС12 дают у г АgCl (по условию);
111 г СаС12 дают 287 г АgС1 (по уравнению);
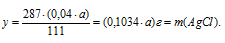
2. Определим массу АgNО3 в исходном растворе.
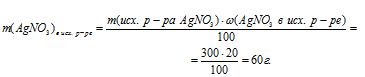
4. Определим массу оставшегося в конечном растворе АgNО3:
m(AgNO3)в кон. р-ре =
= m(AgNO3)в исх. р-ре – m(AgNO3)расход.=
= (60 – 0,1225 . а) г.
5. Используя данные, полученные во втором и четвертом действиях, запишем выражение для массовой доли АgNО3 в конечном растворе:
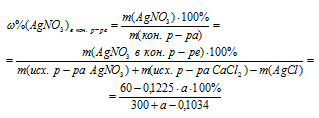
6. Массовая доля АgNО3 в конечном растворе должна быть 5%. Используя выражение, полученное в предыдущем действии, составляем математическое уравнение:
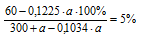
Решая его, получим: а = 267,9 г.
Величиной «а» мы обозначали массу исходного раствора СаС12, следовательно: m2 исх. р-ра = 267,9 г.
Ответ: mр-ра(СаС12) = 267,9 г.