Задача на определение массы использованного вещества после реакции
Задача 1.
При добавлении твердого КОН к 150 г 30% раствора азотной кислоты ее массовая доля снизилась до 7%. Определите массу использованного КОН.
Дано:
масса исходного раствора: mисх. р-ра = 150 г;
массовая доля НNО3 в исходном р-ре:  НNО3)в исх. р-ре = 30%;
НNО3)в исх. р-ре = 30%;
массовая доля НNО3 в конечном р-ре: (НNО3)в кон. p-ре = 7%;
(НNО3)в кон. p-ре = 7%;
Найти:
массу гидроксида калия: m(КОН) = ?
Решение:
Снижение концентрации азотной кислоты произошло вследствие ее частичной нейтрализации:
КОН + НNО3 = КNО3 + Н2О
Решение задачи осложняется тем, что исходный и конечный растворы разные по качественному составу. Исходный раствор состоял только из НNО3 и Н2О и масса азотной кислоты в нем легко определяется:
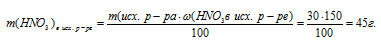
Конечный раствор, кроме оставшейся азотной кислоты и воды содержит также продукты реакции нейтрализации:
КNО3 и Н2О.
Массовая доля азотной кислоты в конечном растворе определяется по отношению к новому, более сложному и более тяжелому раствору.
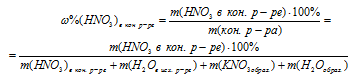
По этой причине, исходный и конечный растворы нельзя сравнивать между собой1. Данная задача и по условию и по алгоритму решения очень похожа на задачи «на разбавление растворов». В них также происходит уменьшение концентрации одного из растворенных веществ. Только там падение концентрации происходит из-за увеличения массы раствора путем разбавления. В нашем же случае действуют два фактора: во-первых, уменьшается количество растворенного вещества (НNО3) из-за реакции; во-вторых, растет масса самого раствора из-за добавления КОН.
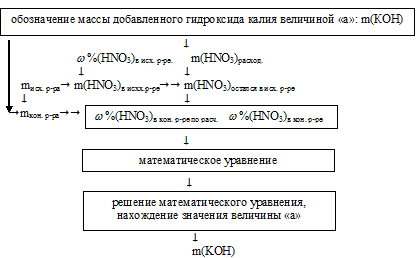
1. Искомой величиной является масса добавленного гидроксида калия. Ее и обозначим величиной «а»: m(КОН) = а г.
2. Используя величину «а» как известную, определим массу расходовавшейся азотной кислоты.
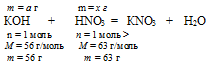
Составляем пропорцию:
а г КОН взаимодействуют с х г НNО3 (по условию)
56 г КОН взаимодействуют с 63 г НNО3 (по уравнению)
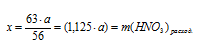
3. По массе исходного раствора определяем массу НNО3 в нем:
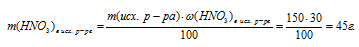
4. Определяем массу НNО3 в конечном растворе после реакции.
m(HNO3)осталось в кон. р-ре = m(HNO3) в исх. р-ре – m(HNO3) расход. = (45 – 1,125 . а) г.
5. Записываем выражение для определения массовой доли HNO3 в конечном растворе. При этом учтем, что масса конечного раствора складывалось из суммы масс исходного раствора и добавленного гидроксида калия.
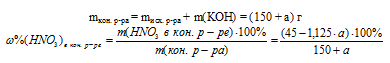
6. Массовая доля HNO3 в конечном растворе по условию должна быть 7%. Используя выражение для (HNO3)в кон р.ре, полученное в предыдущем действии, составим математическое уравнение:
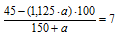
Решая его, получаем: а = 28,9 г.
Величиной «а» мы обозначали массу добавленного гидроксида калия: m(КОН) = 28,9 г.
Ответ: m(КОН) = 28,9 г.
Комментарии:
1Одной из самых распространенных ошибок при решении подобных задач является непонимание различий между начальным и конечным растворами. Большинство учащихся считают, что они отличаются только концентрацией азотной кислоты, и сразу находят массу расходовавшейся HNO3 по уменьшению массовой доли. Применительно к данному случаю обычно действуют так:
(HNO3 в исх. р-ре) – (HNO3 в кон. р-ре) = 30 – 7 = 23%.
Далее определяют массу 23% от массы исходного раствора. Полученную величину обычно считают массой расходовавшейся HNO3 и по ней рассчитывают все остальные значения. Такую грубую ошибку допускают даже ученики, успешно решавшие до этого задачи на разбавления растворов.

