Задача на определение объема, выделившегося газа после реакции
Задача 2.
Через 850 г 4%-ного раствора бромида калия пропустили некоторое количество хлора. После реакции раствор выпарили и получили 28,45 г твердого осадка. Определите объем хлора (н.у.), вступившего в реакцию с КВг, и массу каждого из продуктов в твердом остатке.
Дано:
массаая доля КВг в исходном растворе:  (КВг)в исх. р-ре = 4%;
(КВг)в исх. р-ре = 4%;
масса твердого остатка: mостатка = 28,45 г.
Найти:
объем хлор исходного раствора: mисх. р-ра = 850 г;
массова (н.у.): V(С12) = ?
массу каждого из продуктов в твердом остатке.
Решение:
В условии описана реакция окисления ионов Вг–1 газообразным хлором:
2КВг + С12 = 2КС1 + Вг2.
Но в условии не указано, сколько бромида калия прореагировало с хлором. При недостаточном количестве С12 часть исходного КВг могло остаться. В результате может образоваться раствор двух солей: КС1 и КВг, которые останутся в твердом остатке после выпаривания (Вг2 при нагревании испарится). Поэтому, в первую очередь, мы будем определять массу вступившего в реакцию бромида калия.
Воспользуемся встречным алгоритмом, который предполагает составление математического уравнения.
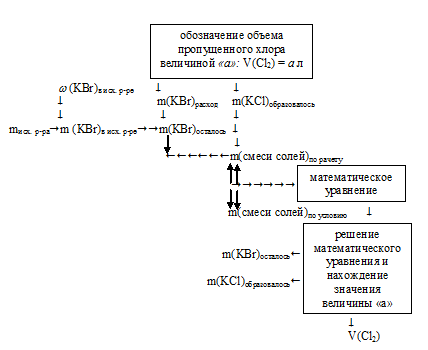
1. Исходной величиной в задаче является объем С12. Обозначим его величиной «а»: V(Cl2)= а л.
2. Используя величину «а» как известную, по уравнению химической реакции находим массу образовавшегося КС1 и массу расходовавшегося КВг.
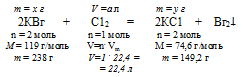
Составляем пропорции:
х г КВг взаимодействуют с а л С12 (по условию)
238 г КВг взаимодействуют с 22,4 л С12 (по уравнению)
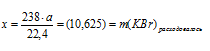
3.Определим массу КВг в исходном растворе
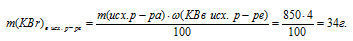
4. Определяем массу КВг, которая осталась после реакции:
m(КBr)осталось = mКВг)в исх. р-ре – m(КВг)расход. = 34 – (10,62 . а) г.
5. Определим массу смеси солей по данным, полученным в 1 и 3 действиях:
m(смеси солей) = (6,661 . а) + 34 – (10,625 . а).
6. Составим математическое уравнение, используя данную в условии массу смеси солей:
(6,661 . а) + 34 – (10,625 . а) = 28,45.
Решая это уравнение, получаем: а = 1,4.
Величиной «а» мы обозначали объем пропущенного хлора, следовательно: V(С12) = 1,4 л.
Определим массу каждого компонента в твердом остатке.
Для этого подставим в выражение для массы КС1 (из действия 1) значения величины «а».
m(КС1)образов. = 6,661 . а = 6,661 . 1,4 = 9,33 г.
Для определения массы оставшегося КВг подставим знания «а» в выражение, полученное в 3-м действии.
m(КВг)осталось = 34 – 10,625 . а = 34 – 10,625 . 1,4 = 19,12 г.
Массу КВг можно было определить и по разнице:
m(КВг)осталось = m(твердого осадка) – m(КС1)образовалось =
= 28,45 – 8,33 = 19,12 г.
Ответ: V(С12) = 1,4 л (н.у.); m(КС1) = 9,33 г; m(КВг) = 19,12 г.

