Определение мольной доли каждого из веществ раствора
Мольная доля - способ выражения состава раствора, который показывает вклад количества вещества (n, моль) одного из веществ в сумму количеств всех веществ (n, моль) раствора и определяется по соотношению:
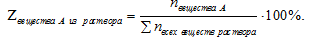
где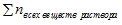 — сумма количеств (п, моль) всех веществ, входящих в раствор.
— сумма количеств (п, моль) всех веществ, входящих в раствор.
Для раствора одного вещества в растворителе эта формула принимает вид:
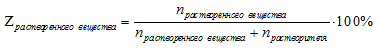
Рассмотрим примеры решения нескольких задач на тему: "Мольная доля".
Задача 1.
Определите мольную долю каждого из веществ раствора, образованного из 0,7 моль Н2SО4 и 12 моль Н2О.
Дано:
количество вещества серной кислоты: Z(Н2SО4) = 0,7 моль;
количество вещества воды: Z(Н2О) = 12 моль.
Найти:
мольную долю серной кислоты; мольную долю воды.
Решение:
Воспользуемся соотношением для мольной доли.

Сумма мольных долей всех веществ раствора равна 100% .
Поэтому мольную долю воды в данном случае можно было определить и путем вычитания.
Z (Н2О) = 100% – Z (Н2SО4) = 100% – 5,51% = 94,49%.
Ответ: Z(Н2SО4) = 5,51% ; Z(Н2О) = 94,49%.
Часто мольную долго выражают не в процентах, а в долях от единицы. В этом случае в формуле для ее вычисления исчезает умножение на 100%. Значение мольной доли, выраженной в долях от единицы в 100 раз меньше, чем при выражении в процентах. Так, в последней задаче мольная доля серной кислоты, выраженная в долях от единицы, будет:
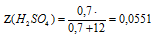
Мольная доля воды:
Z (Н2О) = 1 – 0,0551 = 0,9449.
Единиц измерения мольная доля не имеет.
Если в условии после значения мольной доли не стоит знака % и само значение меньше единицы, то мольная доля выражена в долях от единицы.
Задача 2.
В некотором количестве воды растворили две соли КС1 и NаС1. Мольная доля воды оказалась равной 0,96, а мольная доля NаС1 в 3 раза большее мольной доли КС1. Определите количества всех веществ (n, моль) в растворе, если известно, что масса растворенного хлорида натрия 5 г.
Дано:
мольная доля воды: Z(Н2О) = 0,96;
отношение мольных долей КС1 и NаС1: 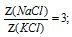
масса хлорида натрия: m(NаС1) = 5 г.
Найти: количество вещества КС1; количество вещества NаС1; количество вещества Н2О.
Решение:
Растворенные соли не взаимодействуют друг с другом, поэтому раствор состоит из трех веществ: КСl; NаСl и Н2О.
Схематично алгоритм решения будет следующим:
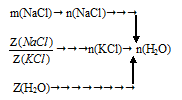
1. Определим количество вещества NaCl:
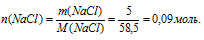
2. Определим количество вещества КСl:
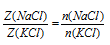
Запишем соотношения для определения мольной доли NаСl и КСl.
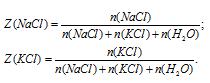
После деления одного выражения на другое, знаменатель во второй части сокращается, и мы получаем:
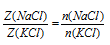
По условию 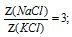 а n(NаСl) мы уже определили в первом действии. Это дает нам возможность найти nКСl).
а n(NаСl) мы уже определили в первом действии. Это дает нам возможность найти nКСl).
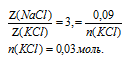
3. Далее определяем количество вещества (п, моль) воды.
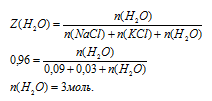
Ответ: n(NаС1) = 0,09 моль; n(КС1) = 0,03 моль; n(Н2О) = 3 моль.
Задача 3.
50,0 л газообразного хлороводорода (НСl) (н.у.) растворили в 2 л воды. Определить мольную долю каждого из веществ в полученном растворе.
Дано:
объем газообразного хлороводорода: V(НСl) = 50 л;
объем воды: V(H2О) = 2 л.
Найти:
мольную долю хлороводорода в растворе;
мольную долю воды в растворе.
Решение:
Схематично алгоритм решения можно представить так:
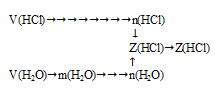
Хлороводород при нормальных условиях представляет собой газообразное вещество1. Поэтому при (н.у.) к нему применимо следствие из закона Авагадро о молярном объеме газа.
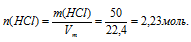
Вода при тех же нормальных условиях является жидкостью. В этом случае неприменим закон Авагадро2. Определим массу воды, используя ее плотность (р(Н2О) = 1 г/мл).
m(Н2О) = V . р = 2000 мл . 1 г/мл = 2000 г.
Теперь через молярную массу воды переходим к количеству вещества.
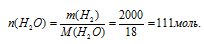
Используя соотношение для мольной доли, вычислим ее для каждого вещества раствора (в долях от единицы).
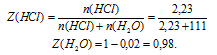
Ответ: Z(НС1) = 0,02; Z(Н2О) = 0,98.
Итак, при решении задач на определение мольной доли в первую очередь необходимо найти количества вещества (n, моль) всех участников раствора.
Комментарии:
1В большинстве опытов, которые вы наблюдали в школе на уроках химии, использовалась жидкость с названием «хлороводородная кислота»., или «соляная кислота». На большинстве склянок с этой кислотой просто указывается формула НС1. На самом деле вы видели раствор хлороводорода в воде. Вещество НС1 в чистом виде при обычных условиях представляет собой газ! Названия «хлороводородная кислота» или «соляная кислота» обозначают жидкий раствор НС1 в воде. Если в задачах количество НС1 выражено в объемных единицах (л, мл, м3) и дана ссылка на нормальные условия или конкретные температуру и давление, то речь однозначно идет о газообразном хлороводороде.
2 Применение молярного объема из следствия закона Авогадро для жидкостей является очень грубой и, к сожалению, распространенной ошибкой, свидетельствующей о непонимании материала.

