Задачи на смеси исходных веществ с параллельно протекающими реакциями1
Задача 1.
Раствор, содержащий 34 г смеси гидроксида калия и гидроксида натрия нейтрализовали избытком соляной кислоты. В результате образовалось 47,9 г солей. Определите массу каждого из гидроксидов в исходной смеси.
Дано:
масса смеси гидроксидов в исходном р-ре: m(КОН+NаОН) = 34 г;
масса солей после нейтрализации раствора: mсмеси солей = 47,9 г.
Найти:
массу гидроксида калия в исходной смеси: m(КОН) = ?
массу гидроксида натрия в исходной смеси: m(NаОН) = ?
Решение:
Оба компонента смеси (КОН и NаОН) одновременно взаимодействуют с соляной кислотой. Записываем для каждого из веществ смеси свою химическую реакцию:
КОН + НСl = КСl + Н2О;
NаОН + НСl = NаСl + Н2О.
Решить данную задачу можно, применив встречный алгоритм. Его можно представить следующим образом:
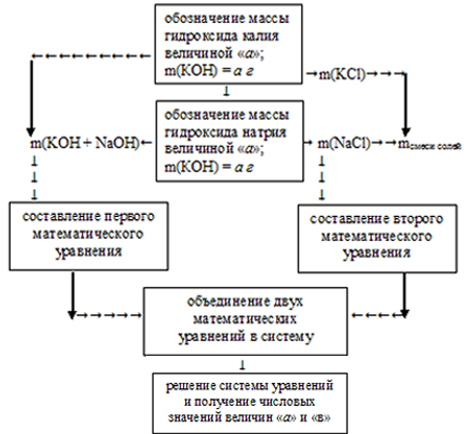
В условии требуется определить массу каждого из гидроксидов, поэтому обозначим массу КОН величиной «а» и массу NаОН величиной «в».
1. Используя введенные значения, составим первое математическое уравнение. Для этого приравняем сумму масс гидроксидов к общей их массе в исходном растворе:
а + b= m(КОН + NаОН) = 34 г,
а +b = 34.
Получилось одно математическое уравнение с двумя неизвестными.
2. Теперь, используя величины «а» и «в» как известные, по уравнениям реакций нейтрализации определяем массы полученных солей:
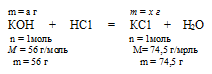
Составляем пропорцию:
а г КОН дают x г КСl (по условию);
56 г КОН дают 74,5 г КСl (по уравнению).
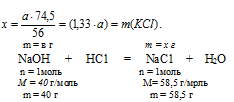
Составляем пропорцию:
в г NаОН дают х г NаСl (по условию);
40 г NаОН дают 58,5 г NаСl (по уравнению).
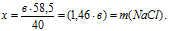
3. Из условия известно, что суммарная масса полученных солей составляет 47,9 г. Используя полученные в предыдущем действии значения, составляем второе математическое уравнение с двумя неизвестными:
m(КСl) + m(NаСl) = (1,33 . а) + (1,46 . b) = 47,9 г;
(1,33 . а) + (1,46 . b) = 47,9.
4. Объединяем два математических уравнения в систему:
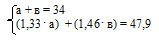
Решение этой системы уравнений дает значения:
а = 13,4 г; в = 20,6 г.
Величиной «а» мы обозначали массу КОН, следовательно:
m(КОН) = 13,4 г;
величиной «в» мы обозначали массу NаОН, следовательно:
m(NаОН) =20,6 г.
Ответ: m(КОН) = 13,4 г; m(NаОН) = 20,6 г.
Задача 2.
92 г смеси карбоната кальция и безводного нитрата кальция прокалили до окончания выделения газов. В результате выделилась смесь газов с относительной плотностью по водороду 21,63. Определите массу каждой соли в исходной смеси.
Дано:
масса смеси солей: mисход. cмеси [СаСО3) + Са(NО3)2] = 92 г;
относительная плотность смеси газов по водороду: D(Н2) = 21,63.
Найти:
массу карбоната кальция в исходной смеси: m(СаСО3) = ?
массу нитрата кальция в исходной смеси: m[Са(NО3)2] = ?
Решение:
Запишем реакции разложения каждой из солей:
СаСО3 = СаО + СО2↑;
2Са(NO3)2 = 2СаО + 4NO2↑ + О2↑.
Для решения придется использовать встречный алгоритм:
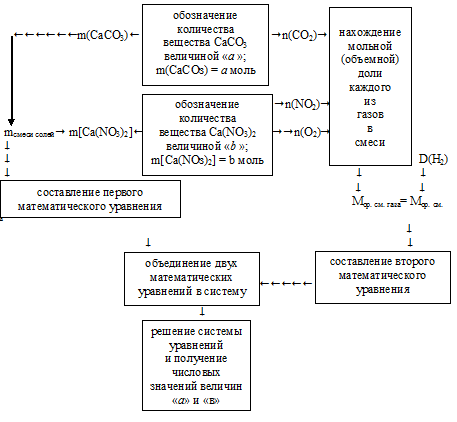
Применим представленный алгоритм.
1. Искомыми величинами являются массы солей в исходной смеси. Для большего удобства дальнейших расчетов разумнее величиной «а» обозначать количество вещества (n, моль) карбоната кальция:
n(СаСО3) = а моль.
Величиной «b» обозначим количество вещества (n, моль) нитрата кальция:
n[Са(NO3)2] = b моль.
Соответственно, через молярные массы этих солей можно перейти к массам самих солей:
m(CaCO3) = М(СаСОз) . n(СаСO3) = (100 . а) г;
m[Са(NO3)2] = М[Са(NO3)2] . n[Са(NO3)2] = (164 . b) г.
2. Общая масса исходных солей указана в условии. Это позволяет составить первое математическое уравнение с двумя неизвестными:
(100 . а) + (164 . b) = 92.
3. Далее, используя введенные величины «а» и «в», по уравнениям реакций разложения определяем количество вещества каждого из газов:
n = a моль n = x моль
CaCO3 = CaO + CO2 ↑
n = 1 моль n = 1моль
Составим пропорцию:
а моль СаСО3 дают х моль СО2 (по данным условия);
1 моль СаСО3 дают 1 моль СО2 (по уравнению);
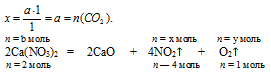
Составим пропорции:
b моль Са(NO3)2 дают х моль NО2 (по данным условия);
2 моль Са(NO3)2 дают 4 моль NО2 (по уравнению);
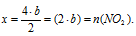
b моль Са(NO3)2 дают у моль О2 (по данным условия)
2 моль Са(NO3)2 дают 1 моль О2 (по уравнению)
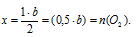
4. Определим мольную долю каждого из газов в смеси (в долях от единицы).
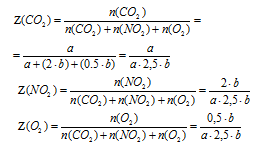
5. Определим среднюю молярную массу смеси газов по значениям их мольных долей в смеси.
Мcр.смеси газов =
= М(СО2) . (СО2) + М(NО2) . (NO2) + М(O2) . (О2).
По закону Авагадро мольная доля газа в смеси численно равна объемной доле (только для газов), поэтому в формулу для определения Мcр вместо объемной доли (Z) подставляем
значение мольной доли (Мср ) соответствующего газа:
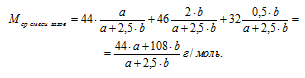
6. Определим среднюю молярную массу смеси газов по данным об относительной плотности:
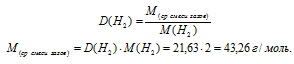
7. Приравнивая друг другу выражения Мср. смеси газов полученные в двух предыдущих действиях, составляем второе математическое уравнение:
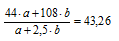
8. Объединяем уравнения, полученные во втором и седьмом действиях в систему
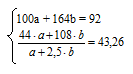
При ее решении получаются значения: а = 0,1; b = 0,5.
Величинами «а» и «b» мы обозначали количество вещества СаСО3 и Са(NO3)2 в исходной смеси солей, следовательно:
n(СаСО3) = 0,1 моль; n[Са(NO3)2] = 0,5 моль.
9. Определяем массы солей в исходной смеси:
m(СаСО3) = n(СаСО3) . М(СаСО3) =
= 0,1 . 100 = 10 г;
m[Са(NO3)2] = n[Са(NO3)2] . M[Са(NO3)2]) =
= 0,5 . 164 = 82 г.
Ответ: m(СаСО3) = 10 г; m[Са(NO3)2] = 82 г.
Комментарии:
1 С химической точки зрения в задачах этой группы происходит взаимодействие какого-либо одного реактива со смесью веществ. Причем все вещества смеси участвуют в реакции, но для каждого из них записывается свое химическое уравнение.
Это, так называемые, параллельные реакции. Селективные же реактивы, для выявления количества какого-либо одного участника смеси не используются. В условии задачи чаще всего присутствует информация об общем количестве исходной смеси и об общем количестве расходовавшегося реактива либо образовавшегося продукта. По этим данным обычно требуется выявить количественный состав исходной смеси.
Основная особенность этих задач заключается в том, что при их решении применяют встречный алгоритм с составлением системы математических уравнений. Рассмотрим несколько примеров решения подобных задач.

