Решение задач на приготовление растворов. Молярность раствора
Приготовление раствора с известной молярностью
Рассмотрим задачу, в которой концентрации разных веществ выражены различными способами. В этом случае наиболее разумно перевести концентрации всех растворов в массовую долю и лишь после этого приступать к решению задачи.
3адача 51.
Какие массы 6,1 М раствора NаОН в воде (р = 1,219 г/мл) и 4% (масс.) необходимо взять для приготовления 500 г 2,77 молярного (р = 1,109 г/мл) раствора NаОН?
Дано:
молярная концентрация 1-го р-ра: СM(NаОН)в 1 исх. p-pа = 6,1 моль/л;
плотность 1-го р-ра: pр-ра = 1,2 19 г/мл;
массовая доля NаОН во 2-м растворе:  (NаОН)во 2 p-ре = 4%;
(NаОН)во 2 p-ре = 4%;
масса конечного раствора m = 500 г;
молярная концентрация конечного р-ра: СM(NаОН) = 2,77моль/л.;
плотность конечного раствора: ркон р-ра = 1,109 г/мл.
Найти:
массы 1-го и 2-го исходных растворов: m1исх р-ра; m2 исх. р-ра.
Решение:
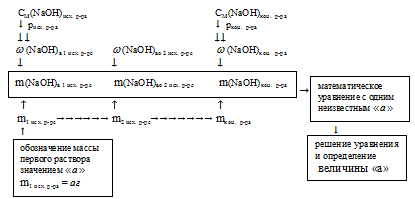
Отобразим условие задачи в виде рисунка:

Молярность непосредственно связана с объемом. Но при изменении концентрации меняется плотность раствора. Это приводит к тому, что сумма объемов исходных растворов не равна объему конечного. Поэтому все расчеты необходимо проводить, основываясь на массовой доле.
Схематично алгоритм решения можно представить так:
Сначала перейдем от молярных концентраций к массовой доле для конечного и первого исходного раствора.
а) Первый исходный раствор.
Проведем расчет для 1 л 6,1 молярного раствора. В нем содержится 6,1 моль NаОН.
m(NаОН) = n(МаОН) . М(NаОН) =
= 6,1 . 40 = 244 г.
Масса 1 л раствора определяется по его плотности.
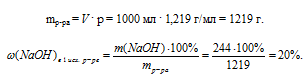
б) Конечный раствор.
Проведем расчет для 1 л раствора с молярной концентрацией 2,77 моль/л.
В 1 литре этого раствора содержится 2,77 моль NаОН.

1. Обозначим массу первого исходного 20%-ного раствора NaОН величиной «а»: m1исх р-ра = а г.
Тогда масса второго исходного 4%-ного раствора NaОН получится:
m2 исх. р-рa = mкон. р-рa – m1 исх. р-рa = (500 – а)
2. Теперь определяем массу чистого NaОН в каждом из трех растворов:
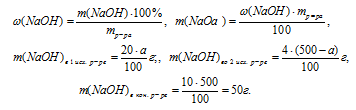
3. Масса чистого NaОН в конечном растворе складывается из сумм масс NaОН в исходных двух растворах. Составим математическое уравнение:
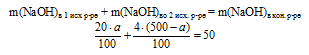
Решая его, получаем: а = 187,5.
4. Величиной «а» мы обозначали массу первого 20%-ного раствора, следовательно: m1 исх. р-ра = 187,5 г
Массу же второго исходного раствора мы получим как разность масс конечного и первого исходного растворов:
m2 исх. р-рa = mкон. р-рa – m1 исх. р-рa =
= 500 – 187,5 = 312,5 г.
Ответ: m1 исх. р-ра = 187,5 г; m2 исх. р-ра = 312,5 г. Необходимо взять 187,5 г 6,1 молярного раствора и 312,5 г 4% раствора.
Определение объемов сливаемых друг с другом растворов с известной молярностью
Решим задачу, в которой требуется определить объем сливаемых друг с другом растворов при известной молярной концентрации.
Задача 52.
Определить объем 4,5 М (р = 1,26 г/мл) и 1,3 М (р = 1,08 г/мл) растворов Н2SO4, необходимых для приготовления путем их смешивания 2,8 М раствора (р = 1,17 г/мл) объемом 300 мл.
Дано:
молярная концентрация 1-го р-ра: СM(Н2SO4) в 1 исх. р-ре = 4,5 моль/л;
плотность 1-го раствора: р1исх. р-ра = 1,26 г/мл;
молярная концентрация 2-го р-ра: СМ(Н2SO4)во2 исх. р-ре =1,3 моль/л;
плотность 2-го раствора: р2 исх.р-ра = 1.08 г/мл;
молярная концентрация конечного р-ра: СМ(Н2SO4)кон. р-ра = 2,8 моль/л;
плотность конечного раствора: ркон. р-ра = 1,17 г/мл;
объем конечного раствора: Vкон. р-ра = 300 мл.
Найти:
объемы исходных растворов: V1 исх. р-ра; V2 исх. р-ра.
Решение:
Отобразим условие задачи в виде рисунка:

Так как V1 исх. р-ра + V2 исх. р-ра ≠ Vкон. p-ра. Следовательно, нам не удастся объем второго раствора выразить как разность между объемом конечного и первого растворов. Остается единственный вариант, перейти от молярных концентраций к массовым долям. Далее вычислить массы каждого из исходных растворов и вновь вернуться к объему.
Схематично алгоритм решения можно представить так:
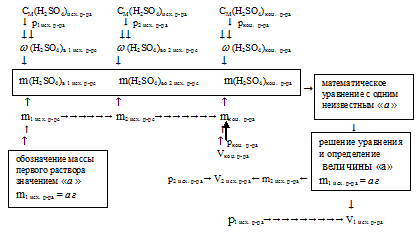
1. Определим массу конечного раствора, зная его объем и плотносnь, получим:
mкон. р-ра = Vкон. р-ра . ркон. р-ра =
= 300 мл . 1,17 г/мл = 351 г.
2. Перейдем от молярных концентраций к массовой доле для первого и второго исходных растворов и конечного раствора.
а) Первый исходный раствор.
Проведем расчет для 1 л 4,5 молярного раствора. В нем содержится 4,5 моль H2SO4.
m(H2SO4) = n(H2SO4) . М(H2SO4) =
= 4,5 . 98 = 441 г.
Масса 1 л раствора определяется по его плотности.
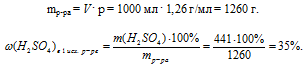
б) Второй исходный раствор..
Проведем расчет для 1 л раствора с молярной концентрацией 1,3 моль/л.
В 1 литре этого раствора содержится 1,3 моль H2SO4.
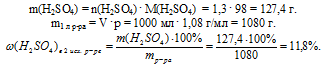
в) Конечный раствор..
Проведем расчет для 1 л раствора с молярной концентрацией 2,8 моль/л.
В 1 литре этого раствора содержится 2,8 моль H2SO4.
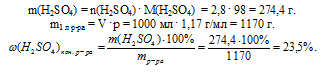
Определяем массу чистого H2SO4 в каждом из трех растворов:

3. Масса чистого H2SO4 в конечном растворе складывается из сумм масс H2SO4 в исходных двух растворах. Составим математическое уравнение:

Решая его, получаем: а = 176,3.
4. Величиной «а» мы обозначали массу первого 35%-ного раствора, следовательно: m1 исх. р-ра = 176,3 г;
m2 исх. р-ра = mкон. р-ра – m1 исх. р-ра =
= 351 – 176,3 = 174,7 г.
5. Рассчитаем объемы исходных растворов, используя формулу:
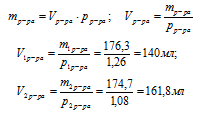
Ответ: необходимо смешать 140 мл 4,5 М раствора с 161,8 мл 1,3 М раствора.

