Определение формулы нитрата аммония
Задача 1.2.
Образец некоторого неорганического вещества содержит 66,5 г азота, 9,5 г водорода, 114 г кислорода. Определите формулу этого соединения.
Дано:
масса азота: m(N) = 66,5 г;
масса водорода: m(Н) = 9,5 г;
масса кислорода: m(О) = 114 г.
Найти: формулу вещества.
Решение:
Шаг 1. Из условия однозначно следует, что вещество состоит только из азота, водорода и кислорода. Обозначим формулу как NхНуОz. Следовательно, требуется определить неизвестные индексы х, у, z.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n) азота, водорода и кислорода в данном образце. Используем соотношение: m = n . М.
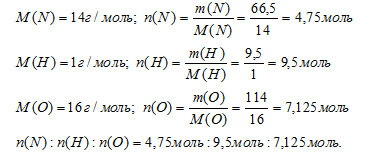
Шаг 4. Находим простейшую формулу.
Следуя выводу, сделанному при рассмотрении четвертого шага общего алгоритма (в предыдущем разделе), можно записать:
N(N) : N(Н) : N(О) = 4,75 : 9,5 : 7,125
Выбираем наименьшее значение (в данном случае «4,75») и делим на него все три числа:
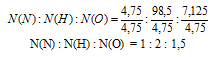
Получили набор чисел, одно из которых не целое. Умножим все числа на «2». Получим:
N(N) : N(Н) : N(О) = 2 : 4 : 3
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: N2Н4О3.
Шаг 5. Выявление истинной формулы.
Такая запись формулы не отражает химической сути вещества. Более того, по элементному составу невозможно однозначно отнести это вещество к какому-либо классу. С таким элементным составом наиболее известны азотная (НNО3) и азотистая (НNО2) кислоты. Но в обоих случаях соотношение азота и водорода в формуле 1 : 1. В нашем же случае соотношение азота и водорода — 1 : 2 . Такому же элементному составу соответствуют аммонийные соли этих кислот: нитрат аммония (NН4NО3) и нитрит аммония (NН4NО2). Соотношению атомов в простейшей формуле N2Н4О3 соответствует истинная формула — NН4NО3. Из последней записи видно, что искомое вещество — соль, состоящая из иона аммония (МН4)+ и кислотного остатка азотной кислоты (NO3)–.
Ответ: NН4NО3.

