"Химия. 11 класс". О.С. Габриелян (гдз)
Получение водорода и кислорода. Изучение свойств водорода и кислорода
Вариант 1. Получение газообразного водорода. Изучение химических свойств водорода.
1. В пробирку налили немного соляной кислоты и опустили гранулу цинка. Пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили в другую пробирку, перевернутую вверх дном. Наблюдаем выделение пузырьков газа водорода. Спустя некоторое время вторую пробирку перевернули и поднесли осторожно горящую лучину, Водород сгорает, на стенках пробирки конденсируется вода.
Zn + 2HCl → ZnCl2 + H2↑
2H2 + O2 → 2H2O
Вновь собрали прибор для получения водорода, зарядили его цинком и кислотой. Конец газоотводной трубки опустили в пробирку с оксидом меди(II). Нагрели пробирку с СuО. Стенки пробирки начинают запотевать, а поверхность кристаллов оксида меди(II) становится красной.
CuO + H2 → Cu + H2O.
2. В пробирку поместили кусочек карбида кальция и добавили воды. Пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили в пробирку с бромной водой, и пробирку с перманганатом калия, они обесцветились.
Подожгли газ, выделяющийся из трубки, он сгорает слепящим пламенем.
СaC2 + 2H2O → Ca(OH)2 + C2H2↑;
C2H2 + 2Br2 → CHBr2—CHBr2;
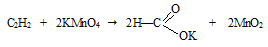 ;
;
2C2H2 + 5O2 → 4CO2 + 2H2O.
Вариант 2. Получение газообразного кислорода. Изучение химических свойств кислорода.
1. В пробирку насыпали немного перманганата калия, внутрь положили комочек ваты и закрыли ее пробкой с газоотводной трубкой. Затем укрепили пробирку на штативе так, чтобы конец трубки доходил до дна стакана, в котором будет собираться кислород. Нагрели пробирку, собрали полный стакан кислорода (полноту стакана проверяем по тлеющей лучине, она вспыхивает) и закрыли стакан картоном.
2KMnO4  K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Раскалили уголь в пламени горелки и опустили его в сосуд с кислородом, он загорелся желто-синим пламенем.
С + О2  СО2.
СО2.
Взяли кусочек серы, положили его в железную ложку и подожгли от пламени. Она загорелась на воздухе синим пламенем, затем переместили ее в сосуд, наполненный кислородом, пламя стало еще ярче.
S + O2  SO2.
SO2.
2. В пробирку поместили немного концентрированной серной кислоты немного этилового спирта и небольшой кусочек пемзы для равномерного кипения. Закрыли пробирку пробкой с газоотводной трубкой и нагрели пробирку в пламени горелки.
C2H5OH  C2H4 + H2O.
C2H4 + H2O.
Выделяющийся газ пропустили в отдельные пробирки с бромной водой и раствором перманганата калия. Растворы быстро обесцвечиваются. Подожгли газ у конца газоотводной трубки, он загорелся светящимся пламенем.
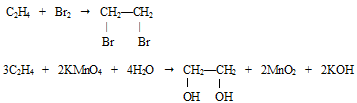
С2Н4 + O2 → 2CO2 + 2H2O.
Вариант 3.
1. Взяли кусок угля, раскалили его в пламени горелки и опустили его в сосуд с кислородом, он загорелся желто-синим пламенем:
С + О2 → СО2.
После сгорания угля в сосуд налили немного известковой воды и взболтали, она помутнела:
Са(ОН)2 + СО2 → СаСО3 + Н2О.
2. В пробирку, снабженную газоотводной трубкой, поместили смесь, состоящую из одной части безводного ацетата натрия и двух частей гидроксида натрия (безводного). Пробирку закрепили на штативе горизонтально и нагрели. Выделяющийся газ пропустили в отдельные пробирки с бромом и раствором перманганата калия. Растворы не изменяют своей окраски. Подожгли газ, выделяющийся из трубки, он горит синим несветящимся пламенем.
СH3COONa + NaOH → Na2CO3 + CH4↑;
CH4 + 2O2 → CO2 + 2H2O.

