Проведение количественного осаждения солей бария
Количественное осаждение нитрата бария
Задача 103.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Ba(NO3)2, навеска массой 0,85 г; осадитель К2SO4, концентрация 1 М.
Решение:
Уравнение реакции осаждения:
Ba(NO3)2 + К2SO4 = BaSO4↓ + 2КNO3.
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
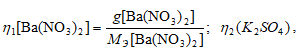
где
MЭ[Ba(NO3)2] = M[Ba(NO3)2]/2 = 261,327/2 = 130,66 г/моль;
MЭK2SO4 = 71,23г/моль..
Согласно закону равенства эквивалентов:
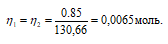
Теперь рассчитаем объём раствора К2SO4, теоретически необходимый для осаждения 0,85 г Ba(NO3)2 из пропорции:
100 : 30 = х : 0,327;
х = (0,327 . 100)/30 = 1,09 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём К2SO4, необходимый для осаждения:
V(К2SO4) = (1,5 . 1,06 )= 1,6 см3.
Условия осаждения:
Определение осложняется тем, что BaSO4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении BaSO4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(К2SO4) = 1,6 см3
Количественное осаждение хлорида бария
Задача 104.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество BaCl2, навеска массой 0,60 г; осадитель AgNO3, концентрация 1 М.
Решение:
Уравнение реакции осаждения:
2AgNO3 + BaCl2 = 2AgCl↓ + Ba(NO3)2.
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
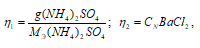
где
СN(AgNO3) = CM(AgNO3) = 1моль;
MЭ(BaCl2) = M(BaCl2)/2 = 208,233/2 = 164,116 г/моль.
Согласно закону равенства эквивалентов:
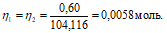
Теперь рассчитаем объём раствора AgNO3, теоретически необходимый для осаждения 0,60 г BaCl2 из пропорции:
1000 : 1 = х : 0,0058;
х = (0.0058 . 1000)/1 = 5,8 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём AgNO3, необходимый для осаждения:
V(AgNO3) = 1,5 . 5,8 = 8,7 см3.
Условия осаждения:
Определение осложняется тем, что AgNO3 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(AgNO3) = 8,7 см3.

