Исследование сульфат железа(II)-диаммония и нитрата свинца
Осаждение сульфат железа(II)-диаммония
Задача 139.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество (NH4)2Fe(SO4)2, навеска массой 0,80г; осадитель NH4OH, концентрация 2 М.
Решение:
Схема реакции осаждения:
(NH4)2Fe(SO4)2 + 2NH4OH =
= Fe(OH)2↓ +2(NH4)2SO4
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
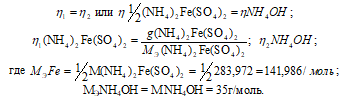
согласно закону равенства эквивалентов:
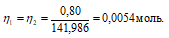
Теперь рассчитаем объём раствора NH4OH, теоретически необходимый для осаждения 0,80 г (NH4)2Fe(SO4)2 из пропорции:
1000 : 2 = х : 0, 0054;
х = (0,0054 . 1000)/2 = 2,7см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём NH4OH, необходимый для осаждения:
V(NH4OH) = (1,5 . 2,7) = 4,05 см3.
Условия осаждения:
Определение осложняется тем, что Fe(OH)2 - аморфное соединение, склонено к уплотнению, что затрудняет последующее отмывание осадка, кроме того при стоянни увеличивается количество примесей, адсорбированных развитой поверхностью аморфного осадка. Fe(OH)2 на воздухе быстро окисляется до Fe(OH)3, поэтому его отфильтровывают сразу же после осаждения и кратковременного отстаивания.
Необходимые условия осаждения:
- Осаждение ведут в присутствии подходящего электролита-коагулятора (обычно это соли аммония), из нагретого анализируемого раствора нагретым раствором осадителя.
- Осаждение ведут из достаточно концентрированного исследуемого раствора концентрированным раствором осадителя.
- Медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка.
- Повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(NH4OH) = 4,05см3.
Осаждение нитрата свинца
Задача 140.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Pb(NO3)2, навеска массой 0,50г; осадитель H2SO4, концентрация 1М.
Решение:
Уравнение реакции осаждения:
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
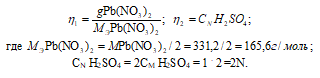
Согласно закону равенства эквивалентов:
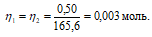
Теперь рассчитаем объём раствора H2SO4, теоретически необходимый для осаждения 0.50г Pb(NO3)2 из пропорции:
1000 : 2 = х : 0,003;
х = (0.003 . 1000)/2 = 1,5 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём H2SO4, необходимый для осаждения:
V(H2SO4) = (1,5 . 1,5) = 2,25 см3.
Условия осаждения:
Определение осложняется тем, что PbSO4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении PbSO4 к раствору добавляют небольшое количество НС1, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(H2SO4) = 2,25 см3.

