Способы получения бутилформиата и гидролиз эфира
Задача 61.
Получите несколькими способами бутилформиат. Проведите механизм реакции этерификации, проведите щёлочный гидролиз полученного эфира. Все продукты назовите.
Решение:
1. Реакция этерификации
Бутилформиат1 - бутиловый эфир муравьиной кислоты получается нагреванием бутилового спирта с муравьиной кислотой в присутствии H2SO4.
Реакция этерификации бутанола и муравьиной кислоты:
НСООН + СН3СН2СН2СН2-ОН = НСООСН2СН2СН2СН3 + Н2О
Реакция протекает как нуклеофильное замещение в карбоксильной группе. В качестве катализаторов этой реакции используют сильные минеральные кислоты H2SO4, H3PO4, хлороводород и др. Роль кислотного катализатора состоит в увеличении эффективного положительного заряда на атоме углерода карбоксильной группы, и, кроме того, протонирование (ОН–) группы на стадии отщепления превращает её в уходящую группу — Н2О. Реакцией с меченым атомом кислорода в спирте удалось установить, что в кислоте разрывается связь (C–O), а в спирте (O–H).
Карбоновая кислота, протонируя карбонильный атом кислорода, увеличивает электрофильность карбонильного углерода и облегчает присоединение слабого нуклеофила (спирта). Потеря воды продуктом присоединения углеводородного радикала приводит к сложному эфиру:
Сначала под действием катализатора карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта.
+
НСООН + Н(+) = Н-С(ОН)2 - катион (1)
Образующийся вначале катион присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (2):
(+) (..)
Н-С(ОН)2 + Н-О-СН2СН2СН2СН3 =
(+)
= Н-С(ОН)2-Н-О-СН2СН2СН2СН3 - катион (2)
Далее катион (2) отщепляет молекулу воды, превращаясь в катион сложного эфира (3):
(+) (+)
Н-С(ОН)2-Н-О-СН2СН2СН2СН3 = Н-С(ОН)-ОН2-О-СН2СН2СН2СН3 =
(+)
= Н-С(ОН)-О-СН2СН2СН2СН3 - катион (3) + Н2О
Катион (3) в результате отщепления протона образует молекулу сложного эфира:
(+)
Н-С(ОН)-О-СН2СН2СН2СН3 = Н-С-О-О-СН2СН2СН2СН3 + Н+
Молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом.
Можно записать схему реакции так:
O O
|| ||
Н- С-ОН + Н-С-О-О-СН2СН2СН2СН3 + (H2SO4) =
= Н - С-О-С-О-О-СН2СН2СН2СН3 + H2O
Механизм реакции этерификации можно представить схемой:
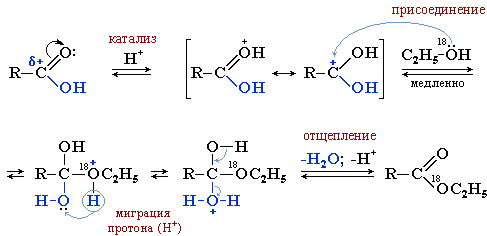
2. Взаимодействие солей карбоновыз кислот с алкилгалогенидами:
НСООK + ClСН2СН2СН2СН3 = НСООСН2СН2СН2СН3 + KCl
3. Получение из карбоновых кислот и алкенов:
НСООH + СН2=СНСН2СН3 + (Н+) = НСООСН2СН2СН2СН3
Гидролиз сложных эфиров
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом). В щелочной среде гидролиз необратим, и в результате его образуются спирт и соль кислоты, при этом требуется эквимолярное количество щёлочи:
НСООСН2СН2СН2СН3 + NaOH = НСООNa + СН3СН2СН2СН2-ОН
Задача 63.
Раствор, содержащий бензальдегид массой 1,612 г в эфире массой 100 г, кипит при температуре 34,806 °C. температура кипения эфира равна 34,5 °с, а эбулиоскопическая постоянная его равна 2. Вычислите относительную молекулярную массу бензальдегида.
Решение:
Повышение температуры кипения равно: ∆tk - повышение температуры кипения раствора = 34,806 – 34,5 = 0,306 . Относительную молекулярную массу бензальдегида вычислим, используя уравнение Рауля:
∆tk = Е(m1 . 1000)/(m2. M), где
Е – эбулиоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества: ∆tk - повышение температуры кипения раствора.
Отсюда
М = Е(m1 . 1000)/(m2 . ∆tk) =
= 2(1,612 . 1000)/(0,306 . 100) = 105,36 г/моль.
Ответ: М(C7H6O) = 105,36 г/моль.
1Бутилформиат; бутиловый эфир муравьиной кислоты; муравьинобутиловый эфир; бутилметаноат.

