"Химия. 10 класс". О.С. Габриелян (гдз)
Свойства карбоновых кислот. Получение сложных эфиров
Опыт 1. Растворимость карбоновых кислот
Условия выполнения работы:
В одну пробирку налили 2 мл воды и добавили 3-4 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили небольшое количество бензойной кислоты, содержимое перемешали, бензойная кислота не растворилась. Затем, пробирку с бензойной кислотой нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.
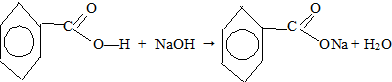
Различие растворимостей кислот можно объяснить молекулярным строением веществ.
Опыт 2. Взаимодействие уксусной кислоты с металлами
Условия выполнения работы:
В пробирку налили немного уксусной кислоты и добавили одну гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.
Уравнение реакции металлического цинка и уксусной кислоты:
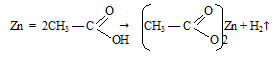
Так как цинк в ряду напряжений металлов стоит до водорода, то уксусная кислота способна с ним реагировать с выделением газообразного водорода.
Все органические и неорганические кислоты способны реагировать с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 3. Получение сложного эфира
Условия выполнения работы:
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и немного концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.
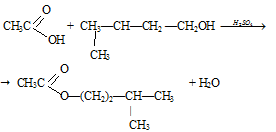
В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие реакции вправо, в сторону образования сложного эфира.

