Решение по химии на определение рН раствора электролита
Задача 538.
Вычислить рН растворов, в которых концентрация ионов Н+ (в моль/л) равна: а) 2 . 10-7 моль/л; б) 8,1 . 10-3 моль/л; в) 2,7 . 10-10 моль/л.
Решение:
Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом
концентрации водородных ионов и называется водородным показателем рН:
рН = -lg[H+]
Округляя значение логарифма до 0,01, получим:
а) рН = -lg2 . 10-7 =
= 7 -lg2 = 7 - 0,30 = 6,70;
б) рН = -lg8,1 . 10-3 =
= 3 -lg8,1 = 3 - 0,90 = 2,10;
в) рН = -lg2,7 . 10-10 =
= 10 -lg2,7 = 10 - 0,43 = 9,57.
Ответ: а) 6,70; б) 2,09; в) 9,57.
Задача 539.
Вычислить рН растворов, в которых концентрация ионов OH- (в моль/л) равна: а) 4,6 . 10-4 моль/л; 6) 5 . 10-6 моль/л; в) 9,3 . 10-9 моль/л.
Решение:
Зная концентрацию иона OH- можно рассчитать концентрацию ионов H+ из соотношения:
K(H2O) = [H+] . [OH-] = 10-14.
Округлив значение логарифма до 0,01, получим:
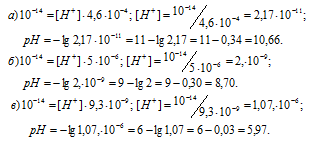
Ответ: а) 10,66; б) 8,70; в) 5,97.
Задача 540.
Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
Решение:
Из выражения [H+] =  CM рассчитаем концентрацию ионов водорода:
CM рассчитаем концентрацию ионов водорода:
[H+] = 0,042 . 0,01 =
= 4,2 . 10-4 моль/л.
Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом концентрации водородных ионов и называется водородным показателем рН:
рН = -lg[H+]
Округляя значение логарифма до 0,01, получим:
рН = -lg4,2 . 10-4 = 4 -lg4,2 =
= 4 - 0,62 = 3,38;
Ответ: 3,38.
Задача 541.
Определить рН раствора, в 1 л которого содержится 0,1 г NаОН. Диссоциацию щелочи считать полной.
Решение:
Так как едкий натр – сильный электролит, который в водных растворах диссоциирует полностью, то концентрация гидроксид-ионов равна концентрации раствора. Находим молярную концентрацию раствора:
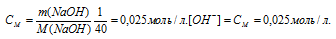
Находим pOH раствора:
pOH = -lg[OH-] = -lg2,5 . 10-3 =
=3 -lg2,5 = 3 - 0,40 = 2,60.
Так как pH + pOH = pH2O, то получим:
pH + pOH = 14; pH =
=14 - pOH = 14 - 2,6 = 11,4.
Ответ: = 11,4.

