Реакции металлов с солями других мталлов
Задача 678.
Никелевые пластинки опущены в водные растворы перечисленных ниже солей. С какими солями никель будет реагировать: а) MgSO4; б) NaCl; в) CuSO4; г) AlCl3; д) ZnCl2; е) Pb(NO3)2?
Решение:
а) MgSO4 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
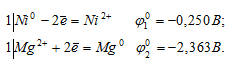
Поскольку  10 >
10 >  20, то окислителем будет служить никель, а восстановителем ион Mg2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить никель, а восстановителем ион Mg2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
б) NaCl + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
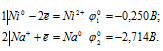
Поскольку  10 >
10 >  20, то окислителем будет служить никель, а восстановителем ион Na+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может само-произвольно протекать в стандартных условиях.
20, то окислителем будет служить никель, а восстановителем ион Na+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может само-произвольно протекать в стандартных условиях.
в) CuSO4 + Ni → NiSO4 +Cu
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
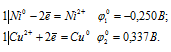
Поскольку  10 <
10 <  20, то окислителем будет служить медь, а восстановителем ион Ni2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить медь, а восстановителем ион Ni2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
г) AlCl3 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
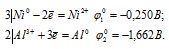
Поскольку  10 <
10 <  20, то окислителем будет служить никель, а восстановителем ион Al3+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить никель, а восстановителем ион Al3+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
д) ZnCl2 + Ni →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
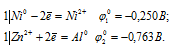
Поскольку  10 >
10 >  20, то окислителем будет служить никель, а восстановителем ион Zn2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить никель, а восстановителем ион Zn2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
е) Pb(NO3)2 + Ni ⇔ Ni(NO3)2 +Pb
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
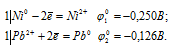
Поскольку  10 <
10 <  20, то окислителем будет служить свинец, а восстановителем ион Ni2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить свинец, а восстановителем ион Ni2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
Ответ: в); е).
Задача 679.
Между какими из перечисленных ниже взятых попарно (металл + водный раствор электролита) будет протекать реакция замещения: а) Ее + НСI; б) Ag + Cu(NO3)2; в) Cu + НСI; г) Zn + MgSO4; д) Мg + NiCl2?
Решение:
а) Ее + НСI → FeCl2 +H2
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
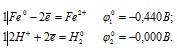
Поскольку  10 <
10 <  20, то окислителем будут служить ионы Н+, а восстановителем железо; рассматриваемая реакция будет протекать слева направо, поэтому процесс может само-произвольно протекать в стандартных условиях.
20, то окислителем будут служить ионы Н+, а восстановителем железо; рассматриваемая реакция будет протекать слева направо, поэтому процесс может само-произвольно протекать в стандартных условиях.
б) Ag + Cu(NO3)2 →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
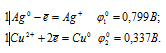
Поскольку  10 >
10 >  20, то окислителем будет служить медь, а восстановителем ион Ag+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить медь, а восстановителем ион Ag+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
в) Cu + НСI →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
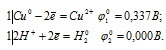
Поскольку  10 >
10 >  20, то окислителем будет служить медь, а восстановителем ион H+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить медь, а восстановителем ион H+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
г) Zn + MgSO4 →
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
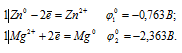
Поскольку  10 >
10 >  20, то окислителем будет служить цинк, а восстановителем ион Mg2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить цинк, а восстановителем ион Mg2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
д) Мg + NiCl2 → MgCl2 + Ni
Запишем стандартные электродные потенциалы электрохимических систем участвующих в реакции:
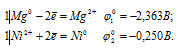
Поскольку  10 <
10 <  20, то окислителем будут служить ион никеля Ni2+, а восстановителем магний; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будут служить ион никеля Ni2+, а восстановителем магний; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
Ответ: а); д).

