Зависимость восстановительных свойств металлов от их стандартных электродных потенциалов
Восстановительные свойства цинка
Задача 1040.
В каких растворах восстановительные свойства цинка выражены более сильно, если
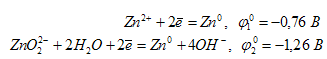
а) в кислых; б) в щелочных?
Решение:
Восстановительные свойства цинка будут выражены более сильно в той среде, в которой значение стандартного электродного потенциала будет наименьшим. Так как стандартный электродный потенциал цинка в щелочной среде (-1,26 В) меньше, чем в кислой (-0,76 В), то восстановительные свойства цинка сильнее выражены в щелочной среде.К
Ответ: б).
Кадмиево-цинковый гальванический элемент
Задача 1041.
Значения стандартных электродных потенциалов систем Zn/Zn2+ и Cd/Сd2+ соответственно равны -0,76 В и -0,40 В. Какая реакция протекает самопроизвольно в кадмиево-цинковом гальваническом элементе:
а) Zn + Сd2+ = Сd + Zn2+;
б) Сd + Zn2+ = Zn + Сd2+.
Решение:
Цинк имеет меньший стандартный потенциал (-0,76 В) и является анодом, на котором протекает окислительный процесс:
Zn - 2 = Zn2+ (1)
= Zn2+ (1)
Кадмий, потенциал которого -0,40 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Cd2+ + 2 = Cd (2)
= Cd (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу гальванического элемента, можно получить, сложив уравнения анодного и катодного процессов, получим:
Zn + Cd2+ = Zn2+ + Cd.
Ответ: а).

