Вычисление потери от растворимости MgNH4PO4 и СаHPO4
Вычисление потери от растворимости осадка магния аммония фосфата при промывании его указанным объёмом хлорида аммония
Задача 220.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок MgNH4PO4, массой 0,25 г, Пр(MgNH4PO4) = 2,5 . 10-13; промывная жидкость NH4Cl, объёмом 500 см3, концентрацией 0,15%.
Решение:
Mr(MgNH4PO4) = 137,279 г/моль;
Мr(NH4Cl) = 71,453 г/моль.
Рассчитаем массу NH4Cl из пропорции:
100 : 0,15 = 1000 : х;
х = (1000 . 0,15)/100 = 1,5 г NH4Cl.
Теперь рассчитаем концентрацию промывочного раствора NH4Cl:
CM(NH4Cl) = m(NH4Cl)/M(NH4Cl) =
= 1,5/71,453 = 0,021 моль/дм3.
Обозначим растворимость MgNH4PO4 моль/дм3 через "х", тогда
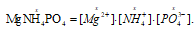
NH4Cl – сильный электролит, и поэтому:
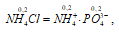
концентрация ионов [NH4+] равна концентрации кислоты:
[NH4+] = 0,0145 моль/дм3.
Так как ионы Mg2+ и поступают в раствор только из осадка, то [Mg2+] . [РО43-] = х . x, а ионы [NH4+] из осадка и из промывной жидкости, тогда [NH4+] = х + 0,2. Поскольку х << 0,021 , то можно считать, что вся концентрация ионов [NH4+] в растворе практически равна его концентрации в промывной жидкости - [NH4+] = 0,2 моль/дм3, а значением х, как очень малой величиной, мы можем пренебречь.
Поскольку Пр(MgNH4PO4) = [Mg2+] . [РО43-] . [NH4+], то, подставив в эту формулу соответствующие значения концентраций ионов, находим:
Пр(MgNH4PO4) = х2 . 0,021.
Откуда
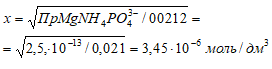
Потери (г) за счёт растворимости равны:
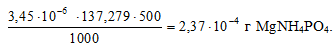
Потери в процентах равны:
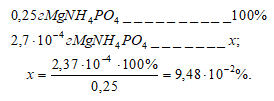
Таким образом, при промывании осадка MgNH4PO4 500 см3 0.15% раствора NH4Cl мы вносим погрешность около одной десятой процента в результате потерь от растворимости.
Ответ: 2,37 . 10-4 г; 9,48 . 10-2%.
Расчет потери от растворимости осадка магния гидрофосфата кальция при промывании его указанным объёмом гидрофосфата натрия
Задача 221.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок СаHPO4, массой 0,35 г, Пр(СаHPO4) = 2,7 . 10-7; промывная жидкость Nа2НРО4, объёмом 400 см3, концентрацией 0,02 М.
Решение:
Mr(СаHPO4) = 136,754 г/моль.
Обозначим растворимость СаHPO4 моль/дм3 через "х", тогда
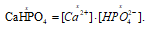
Nа2НРО4 – сильный электролит, и поэтому:
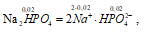
концентрация ионов [НРО42-] равна концентрации соли:
[НРО42-] = 0,02 моль/дм3.
Так как ионы Са2+ поступают в раствор только из осадка, то [Са2+] = х, а ионы НРО42- из осадка и из промывной жидкости, тогда [НРО42-] = х + 0,02. Поскольку х << 0,02 , то можно считать, что вся концентрация ионов НРО42- в растворе практически равна его концентрации в промывной жидкости - [НРО42-] = 0,02 моль/дм3, а значением х, как очень малой величиной, мы можем пренебречь.
Поскольку Пр(СаHPO4) = [Са2+] . [НРО42-], то, подставив в эту формулу соответствующие значения концентраций ионов, находим:
Пр(СаHPO4) = (х . 0,02) = 2,7 . 10-7.
Откуда
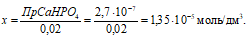
Потери (г) за счёт растворимости равны:
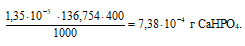
Потери в процентах равны:
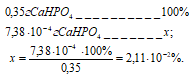
Таким образом, при промывании осадка СаHPO4 400 см3 0.15% раствора Nа2НРО4 мы вносим малую погрешность в результате потерь от растворимости.
Ответ: 7,38 . 10-4 г; 2,11 . 10-2%.
Задачи на расчт потери от растворимости соли:
1. Расчт потери от растворимости вольфромата кальция
2. Расчт потери от растворимости сульфата бария
3. Расчт потери от растворимости хромата свинца

