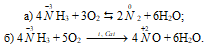Характеристика соединений азота
Задача 883.
Растворимость NH4Cl и NaNO2 при 20 °С составляет соответственно 37,2 и 82,9 г в 100 г воды. Сколько граммов насыщенных растворов этих солей нужно слить для получения при нагревании 24 л азота (20 °С, нормальное атмосферное давление)?
Решение:
М(NH4Cl) = 532,5 г/моль; M(NaNO2) = 85 г/моль.
Уравнение реакции имеет вид:
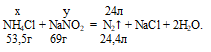
Вычислим необходимое количество граммов NH4Cl и NaNO3 для получения 24 л азота, получим:
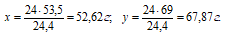
Вычислим сколько граммов насыщенных растворов NH4Cl и NaNO3 для получения 24 л азота, получим:
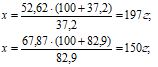
Ответ: 197г и 150 г.
Задача 884.
Какие соединения азота получают путем непосредственного связывания (фиксации) атмосферного азота? Привести реакции их получения и указать условия проведения реакций.
Решение:
а) Получение цианамида. Первым по времени открытия (1904 г.) является цианамидный способ получения аммиака, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция СаС2, образуя цианамид кальция CaCN2:
СаC2 + N2 ↔ CaCN2 + C; ΔH° = -301 кДж.
При действии на цианамид кальция – порошок тёмно-серого цвета, окрашенный примесью угля. При действии на него водяного пара под давлением он легко разлагается с образованием аммиака и карбоната кальция:
CaCN2(к) + 3Н2О(г) 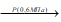
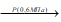 СаСО3(к) + 2NH3(Г); ΔH° = -75 кДж.
СаСО3(к) + 2NH3(Г); ΔH° = -75 кДж.
б) Получение аммиака.
Азот непосредственно взаимодействует с водородом под воздействием электрических разрядов или при нагревании (около 500 0С) и высоком давлении (от 15 до 100 МПа) в присутствии катализатора (железный катализатор) с образованием аммиака:
N2 + 3H2 ↔ 2NH3;
ΔH0 = -92 кДж.
В настоящее время синтез аммиака является основным способом связывания атмосферного азота.
Задача 885.
Сколько тонн цианамида кальция можно получить из 3600 м3 азота (20 °с, нормальное атмосферное давление) при взаимодействии его с карбидом кальция, если потери азота составляют 40%?
Решение:
Уравнение реакции:
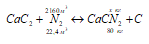
Находим объём азота, вступившего в реакцию:
3600 . 0,6 = 2160 м3.
Теперь рассчитаем массу цианида кальция из пропорции:
22,4 : 80 = 2160 : х;
х = (2160 . 80)/22,4 = 7714 кг или 7,714 т.
Ответ: 7,714 т.
Задача 886.
Привести примеры характерных для аммиака реакций присоединения, замещения водорода и окисления.
Решение:
1) Реакции присоединения для аммиака:
а) NH3 + HCl ↔ NH4Cl;
б) NH3 + H2O ↔ NH4OH.
2) Реакции замещения с участием аммиака:
а) 2NH3 + 2Na ↔ 2NaNH2 + H2↑;
б) NH3 + HOCH2CH2Cl ↔ HOCH2CH2NH2 + HCl
2-хлорэтанол 2-аминоэтанол
3) реакции окисления с участием аммиака: