Характеристика электролитических способов получения щелочных металлов и едких щелочей
Задача 973.
Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электрохимические процессы происходят в том и другом случае?
Решение:
а) Щелочные металлы получают электролизом расплавов их соединений, например, натрий можно получить электролизом расплава хлорида натрия. При этом на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Уравнения реакций электродных процессов при электролизе расплава NaCl:
На катоде: Na+ +  = Na0;
= Na0;
На аноде: Cl¯- = Cl0;
= Cl0;
Cl0 +Cl0 = Cl2↑.
Побочным продуктом является газообразный хлор, который собирают и используют в промышленности.
б) Едкие щёлочи получают электролизом водных растворов солей щелочных металлов, например, едкое натрий получают электролизом водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода (в катодном пространстве) накапливаются ионы натрия и гидрокси-ионы (Na+ и ОН¯). На аноде выделяется хлор. Очень важно чтобы продукты электролиза не смешивались, так как NaOH легко взаимодействует с хлором. Для воспрепятствованию смешивания NaOH и Cl2 применяют диафрагменный метод (устанавливают диафрагму из асбеста или другого пористого материала ). Существуют два метода электролиза соли: Метод стального электрода (катода) и метод ртутного катода, анодом в обеих случаях является угольный стержень.
Уравнения реакций процессов на катоде и аноде при электролизе раствора хлорида натрия:
На катоде: 2Н2О + 2 = Н2↑ + 2ОН¯;
= Н2↑ + 2ОН¯;
На аноде: 2Сl¯ - 2 = Cl20↑.
= Cl20↑.
Молекулярная форма:
2NaCl + 2H2O 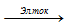 H2↑ + 2NaOH + Cl2↑.
H2↑ + 2NaOH + Cl2↑.
В процессе электролиза в анодное пространство непрерывно поступает раствор NaCl, а из катодного вытекает раствор, содержащий смесь NaCl и NaOH. При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
Если катодом служит ртуть, то у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Полученную при электролизе амальгаму разлагают горячей водой, при чём получается гидроксид натрия и выделяется водород и освобождается ртуть. Этим методом можно получить чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Задача 974.
Как путем электролиза раствора хлорида калия получить гидроксид, гипохлорит и хлорат калия? Написать уравнения происходящих реакций.
Решение:
а) Электролиз (Elektrolyse) раствора хлорида калия – соли образованной при взаимодействии активного металла и бескислородной кислоты протекает предсказуемо. В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН).
Стандартный электродный потенциал системы К+ + 1 = К0 (-2,950 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода:
= К0 (-2,950 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода:
Катод: 2Н2О +2 = H2↑ + 2ОН¯,
= H2↑ + 2ОН¯,
а ионы К+, приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление ионов хлора Cl¯, приводящее к выделению газообразного хлора:
2Сl¯ + 2 + 2Cl0;
+ 2Cl0;
2Cl0 = Cl20↑
Поскольку отвечающей этой системе стандартный электродный потенциал (1,359 В), хотя и больше, чем стандартный электродный потенциал системы:
2Н2О = О2↑+ 4Н+ + 4 (1,228 В), то
(1,228 В), то
разряжаться будут ионы Cl¯. Эта аномалия связана со значительным перенапряжением электродного процесса 2Сl¯ + 2 + 2Cl0.
+ 2Cl0.
По окончании электролиза жидкость у катодного пространства выпаривают. При его выпаривании выкристаллизовываются хлорид калия и остаётся почти чистый гидроксид калия, который выпаривают до полного удаления воды. Затем, гидроксид калия сплавляют в формы. Побочными продуктами электролиза являются газообразные водород и хлор.
б) Получение гипохлорита калия. Для получения гипохлорита калия нужно, выделяющийся при электролизе хлорида калия газообразный хлор, пропустить через раствор гидроксида калия у катодного пространства. При пропускании хлора через исходный раствор едкого калия образуется гипохлорит калия:
2KOH + Cl2 = KCl + KOCl + H2O.
гипохлорит
калия
в) Для получения хлората калия нужно пропустить хлор в горячий раствор гидроксида калия, получим:
6KOH + 3Cl2 = 5KCl + KClО3 + 3H2O.
хлорат
калия
Поскольку хлорат калия малорастворим в холодной воде, то при охлаждении раствора он выпадает в осадок.

